
科目: 来源: 题型:
【题目】如图为Na2SO4的溶解度曲线,已知硫酸钠晶体(Na2SO4·10H2O)在温度为T3K时开始分解为无水硫酸钠。现有142g温度为T2K的饱和硫酸钠溶液,当温度降为T1K或升为T4K(T4>T3)时析出晶体的质量相等,则温度为T4K时Na2SO4的溶解度为( )。
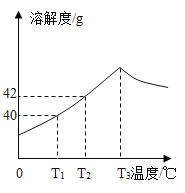
A.30g
B.32.8g
C.40g
D.40.8g
查看答案和解析>>
科目: 来源: 题型:
【题目】向20g某赤铁矿石(主要成分是Fe2O3,假设杂质不溶于水,也不与酸反应)样品中,逐渐加入稀硫酸,充分反应。实验相关数据如图所示。
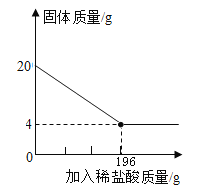
(1)20g赤铁矿石样品中氧化铁的质量为______g
(2)计算试验中所用稀硫酸溶质的质量分数(写出计算过程)
查看答案和解析>>
科目: 来源: 题型:
【题目】2019年12月17日下午,我国首艘国产航母“山东舰”正式交付海军服役。建造航母需要大量的高纯氧化锌。某研究小组设计如下流程制备高纯氧化锌。
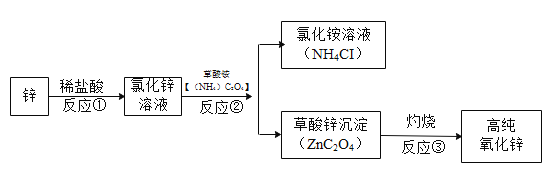
(1)反应①的化学方程式为______
(2)反应②的基本反应类型是______
(3)反应②后进行的分离操作名称是____,若得到的氯化铵溶液有浑浊,原因可能_____(写出一种即可)。
(4)反应③属于分解反应,产物为三种氧化物。其中2种气体的化学式为_____和______。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列是中学化学常用的仪器和装置,请回答:
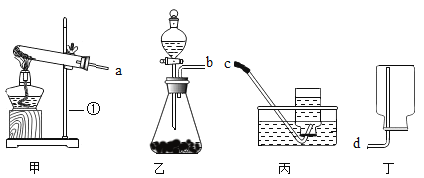
(1)仪器①的名称是______
(2)实验室用双氧水溶液和二氧化锰制取氧气应选择的制气装置为______(填“甲”或“乙”),该反应的化学方程式为______
(3)若以高锰酸钾固体为原料制取氧气,正确的接口连接顺序是____接____,实验前应先____,再加入药品。
查看答案和解析>>
科目: 来源: 题型:
【题目】铬(Cr)是一种重要的金属元素,铬的单质及其化合物应用广泛。重铬酸钾(K2Cr2O7)、NaCl两种物质的溶解度曲线甲、乙如图所示
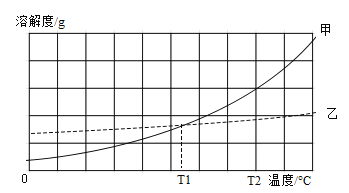
(1)不锈钢通常含铬,不锈钢比钢有更好的______性能
(2)铬桶可以盛装AlC13溶液,不能盛装稀硫酸,则金属活动性Cr____Al(填“>”或“<”)
(3)不能证明Zn和Cr的活动性强弱的试剂组是__A Zn、Cr和CuSO4溶液 B Cr、ZnSO4溶液
(4)图中_______(填“甲”或“乙”)代表重铬酸钾的溶解度曲线。
(5)T2时,分别将甲、乙的饱和溶液降温至T1,得到两种溶液的溶质质量分数关系为甲_____乙(填“>”或“=”或“<”)
查看答案和解析>>
科目: 来源: 题型:
【题目】硫原子的结构示意图、H2S与O2反应的微观示意图如图所示。据此回答问题
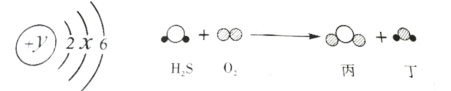
(1)y=_______;硫元素位于元素周期表的第________周期
(2)H2S中硫元素的化合价为____________
(3)丙物质中两种元素的质量比是________________
(4)请补全化学方程式:2H2S+(______)O2=2H2O+(_______) (_______)
查看答案和解析>>
科目: 来源: 题型:
【题目】将6g生铁样品加入到盛有100g质量分数为14.7%的过量硫酸的烧杯中(样品中杂质不溶于水,也不与稀硫酸反应),充分反应后过滤,称得滤液的质量为105.8g,试计算:
(1)该生铁样品中铁的质量分数_____(要写出计算步骤,结果保留一位小数)
(2)如果继续加热生铁样品至没有气泡冒出,过滤,将滤液蒸干,可以得到固体多少克?(固体中不含结晶水)
查看答案和解析>>
科目: 来源: 题型:
【题目】已知D是生活中最常见的液态化合物,G、F、X是单质,通常情况下,E为难溶于水的白色固体,反应⑥为实验室制气体化合物I的常用方法,物质间转化关系如图所示,部分产物已略去。请回答下列问题:
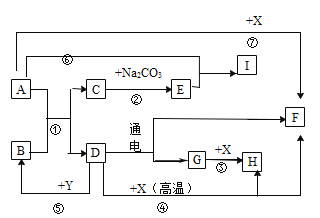
(1)Y中阴离子的结构示意图为_____。
(2)反应①~⑦中属于复分解反应的有_____。
(3)写出反应④的方程式_____。
(4)反应③的现象是_____。
(5)写出反应②的方程式_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】氢化钙固体是登山运动员常用的能源提供剂。某兴趣小组拟选用如下装置制备氢化钙。(提示:氢化钙通常用氢气与钙加热制得,金属钙的化学性质很活泼,容易与氧气、水反应。)
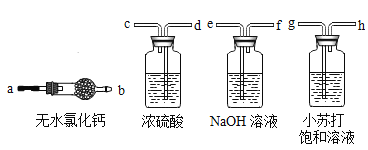
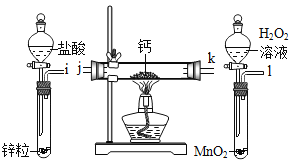
请回答下列问题:
(1)氢化钙属于离子化合物,其阴离子符号为_____。
(2)请选择必要的装置,按气流方向连接顺序为_____→a(填仪器接口的字母编号)。
(3)根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品;打开分液漏斗活塞;_____(请按正确的顺序填入下列步骤的标号)。
A 加热反应一段时间
B 收集气体并检验其纯度
C 关闭分液漏斗活塞
D 停止加热,充分冷却
(4)实验结束后,某同学取少量产物,小心加入水中,观察到有气泡冒出,溶液中加入酚酞后显红色。该同学据此判断,上述实验确有CaH2生成。
①写出CaH2与水反应的化学方程式_____;
②该同学的判断不准确,原因是_____。
(5)通过上述方法制得的氢化钙样品中常混有未完全反应的钙(其余可能的杂质忽略不计)。样品纯度的测定步骤如下:
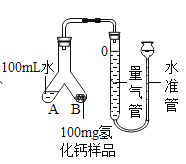
①检查装置气密性,装入药品,按图(固定装置省略)所示连接仪器。
②调整水准管高度,使量气装置两边的液面保持同一水平。读取液面所在的刻度数据为10.0mL。
③将Y形管慢慢倾斜,直到A端的水全部与B端的样品混合。
④反应结束,冷却至室温,再次读取液面所在刻度数据为110.0mL。
回答下列问题:
(5)如何判断样品与水完全反应:_____。
(6)反应生成氢气的体积为_____mL。
(7)已知该实验条件下,氢气的密度为0.09mg/mL。样品中氢化钙的纯度为_____。(结果精确到0.1%)
查看答案和解析>>
科目: 来源: 题型:
【题目】以化合价为纵坐标,物质的类别为横坐标所绘制的图像叫价类图。如图为硫的价类图,请分析该图后填空:
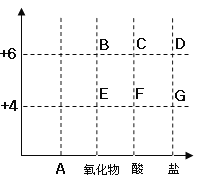
(1)E点表示的是二氧化硫,写出他的一条物理性质_____。
(2)图中可表示K2SO3这种盐的点是_____(填字母);
(3)A点表示的物质类别是_____。
(4)写出由D点表示的化合物与氢氧化钠溶液反应的化学方程式_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com