
科目: 来源: 题型:
【题目】电缆的生产过程中会产生一定量的含铜废料。某化学兴趣小组同学按下列方案分离回收铜,并获得硫酸亚铁晶体。
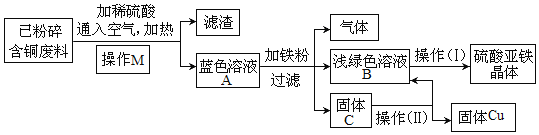
(查阅资料)
①在通入空气并加热的条件下,铜可与稀硫酸反应转化为硫酸铜。反应的化学方程式:2Cu + 2H2SO4 + O2 ![]() 2CuSO4 + 2H2O。
2CuSO4 + 2H2O。
②硫酸亚铁的溶解度随着温度升高而增大(在一定温度范围内)。
(1)操作M名称是_______。
(2)蓝色溶液A中溶质的成分是________(填化学式)。
(3)浅绿色溶液B经系列操作(I)可得硫酸亚铁晶体(FeSO4·7H2O),该操作的顺序为_____(用a、b、c 表示)。
a.冷却结晶 b.过滤 c.加热浓缩
(4)该方案中应该加入略过量的铁粉,铁粉过量的目的是________;从固体C 中获得纯净的铜,操作(Ⅱ)的具体处理方法是:加入_________充分反应后过滤、洗涤、干燥。
查看答案和解析>>
科目: 来源: 题型:
【题目】A-E是初中化学常见的化合物,它们之间的关系如图所示。其中A的浓溶液能挥发出刺激性气味的气体,从C→D的反应过程中有蓝色沉淀生成,E为不溶于硝酸的白色沉淀。“![]() ”表示一种物质能转化为另一种物质(部分反应物、生成物及反应条件已省略)。
”表示一种物质能转化为另一种物质(部分反应物、生成物及反应条件已省略)。
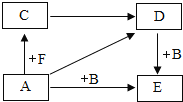
(1)请写出化学式:A____,F______。
(2)在A→E的反应过程中,A与B溶液恰好完全反应,往反应后的溶液中滴入石蕊溶液,观察到的现象为_________。
(3)D→E的化学方程式为_______,该反应的基本反应类型为_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据如图装置,结合所学化学知识回答下列问题:

(1)写出图中仪器①的名称:_______。
(2)实验室常用过氧化氢溶液和二氧化锰制O2,反应的化学方程式是______,如需控制反应速率发生装置最好选用______。
(3)可用E装置收集二氧化碳,是因为______,若用F装置收集氧气,当观察到________时,开始收集。
(4)SO2是有毒气体,密度比空气大,易溶于水。实验室用如图所示装置收集
一瓶干燥的SO2,装置中导管按气流方向连接顺序是:____→____→____→____→ ⑤(填序号),图中NaOH溶液的作用是_________。
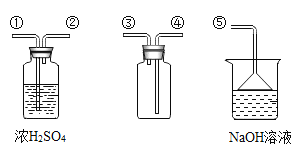
查看答案和解析>>
科目: 来源: 题型:
【题目】实验创新是重要的学科素养。小明用W形玻璃管完成了课本上的两个实验。
(1)探究炼铁原理如图:甲酸(HCOOH)在热的浓硫酸的作用下,分解生成一氧化碳和水,该反应的化学方程式是________,实验时,酒精灯加灯罩的作用是_________,A处可观察到的现象是__________。
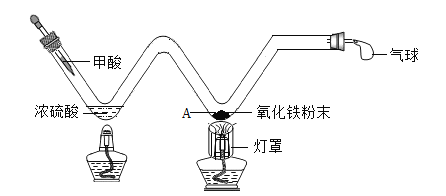
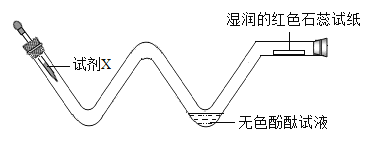
(2)探究微粒性质如图:加入试剂X,观察到无色酚酞试液变红,红色石蕊试纸变蓝。试剂X可能是______,该装置的优点是______(答一点)。
查看答案和解析>>
科目: 来源: 题型:
【题目】碳及碳的化合物在人类生产生活中应用广泛。
(1)金刚石和石墨物理性质相差很大,原因是碳原子的________不同。
(2)家用燃料含有碳元素,燃烧不充分会产生_______气体,与血液中的血红蛋白结合,使人体中毒。
(3)打开一瓶碳酸饮料的瓶盖,塞上带导管的橡皮塞(如图所示):

① A中的现象是______,B中的现象是______。
② A中现象说明气体的溶解度随压强的减小而______。
(4)利用太阳能可将CO2和水转化成合成气(CO和H2),再将CO和H2合成甲醇(CH3OH)。在合成甲醇的反应中,CO和H2的分子数之比是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】用化学用语表示填空:
(1)碳元素_____;
(2)五氧化二磷_____;
(3)葡萄糖_______;
(4)H2SO3中硫元素的化合价_______;
(5)硝酸铵中的阳离子_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是甲、乙两物质的溶解度曲线,下列说法正确的是

A.甲、乙的溶解度都随温度的升高而增大
B.将t2℃时乙的饱和溶液降温至t1℃时,溶液仍旧饱和
C.甲溶液从t2℃降温至t1℃,一定有晶体析出
D.t1℃时,甲、乙两物质饱和溶液的溶质质量分数相等
查看答案和解析>>
科目: 来源: 题型:
【题目】取10.0g碳酸钙高温加热,一段时间后停止加热,剩余固体中钙元素质量分数为50.0%.下列判断正确的是( )
A. 生成2.0g CO2气体
B. 剩余固体的质量为5.0g
C. 生成了5.6g CaO
D. 剩余CaCO3的质量为8.0g
查看答案和解析>>
科目: 来源: 题型:
【题目】小李和小王同学对化学计算很有心得,以下是他们解答一道计算题的实录。请你一起参与研究并完成相关问题。( 计算结果精确到0.01g)
题目已知: ,两位同学为了测定实验室中氯酸钾药品是否纯净,取2. 5g该药品与0. 5g二氧化锰混合。加热该混合物t3时间后(假设杂质不参加反应),冷却,称量剩余固体质量,重复以上操作,依次称得加t2 、t3、t4时间后剩余固体的质量,记录数据如下表:
,两位同学为了测定实验室中氯酸钾药品是否纯净,取2. 5g该药品与0. 5g二氧化锰混合。加热该混合物t3时间后(假设杂质不参加反应),冷却,称量剩余固体质量,重复以上操作,依次称得加t2 、t3、t4时间后剩余固体的质量,记录数据如下表:
加热时间 | t1 | t2 | t3 | t4 |
剩余固体质量/g | 2.12 | 2.08 | 2.04 | 2.04 |
(1)两同学一致认为氯酸钾已经完全反应的时间为_____(选填“t1”、 “t2”、“t3”、“t4”) 。
(2)小李根据质量守恒定律很快得到(2.5g+0.5g-2.04g)是_____(填化学式)的质量。
(3)请你计算:该药品中氯酸钾的质量,并判断该药品是否纯净?_____
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com