
科目: 来源: 题型:
【题目】尿素[CO(NH2)2]是一种目前使用量较大的一种化学氮肥,适用于各种土壤和植物易保存,使用方便。
(1)尿素是一种含氮量很高的氮肥,它能使作物_____________;
(2)溶质质量分数32.5%的尿素溶液可用作柴油汽车尾气处理液,用尿素溶液处理柴油汽车尾气(含NO)时的化学方程式如下(反应条件略去):![]() 。现用含20Kg上述尿素溶液处理汽车尾气,请你回答下列问题:
。现用含20Kg上述尿素溶液处理汽车尾气,请你回答下列问题:
①配制上述尿素溶液,所需尿素的质量是___________kg,水的体积是____________L(水的密度1g/mL);
②计算用上述尿素溶液可除去的NO的质量是________?
③上述反应中,若尿素中氮元素为aKg,则生成的氮气中氮元素的质量是否为akg?________填“是”或“否”),原因是_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】图为某小组探究金属化学性质的两组实验。
实验I | 实验Ⅱ |
|
|
(1)实验Ⅰ中以“金属表面产生气泡的快慢”为标准来判断锌、铁的活动性强弱,有同学认为不够合理,理由是______________,请你写出A试管中发生反应的化学方程式_________________。
(2)写出实验Ⅱ中C试管内发生反应的化学方程式_________________,D实验中观察到的现象是_____________。
(3)实验Ⅱ中要验证Cu、Fe、Ag的金属活动性顺序,至少要做的实验是________(填序号),由此判断出三种金属的活动性由强到弱的顺序是________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】早在春秋战国时期,我国就开始生产和使用金属制品。
I.金属和金属材料在日常生活中有广泛用途。请回答下列问题:
(1)地壳中含量最高的金属元素是__________(填元素符号)。
(2)用铜制作导线,因其有良好的延展性和___________。
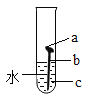
(3)钢铁生锈就是铁与空气中的__________等发生化学反应的过程;如下图试管中最易生锈的部位是____(填“a”、“b”或“c”),请写出一种防止铁制品生锈的方法:______________。
Ⅱ.某化学兴趣小组利用如图装置模拟工业炼铁原理,请按要求填空:
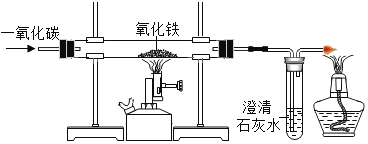
(1)实验中硬质玻璃管内观察到的现象是__________,写出该反应的化学方程式_______________;
(2)实验中盛澄清石灰水的试管中可观察到的现象是_________________;
(3)右边导气管口放置点燃的酒精灯的目的是____________________。
(4)上述实验中,CO气体起到以下三个作用:
①作为反应物;
②实验开始时,先排尽装置中的空气,防止_______________;
③停止加热后,继续通入气体,防止_____________;
(5)工业上得到的生铁属于___________(填“合金”或“纯金属”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】盐酸、硫酸、氢氧化钠是重要的化工原料。
(1)浓硫酸是实验室常用的气体干燥剂,说明浓硫酸具有________性。
(2)稀盐酸和稀硫酸都可以用于金属除锈,是因为他们的溶液中都含有________(填符号)。
(3)实验室有一瓶久置的氢氧化钠固体,为探究其是否变质,同学们进行了如下实验:
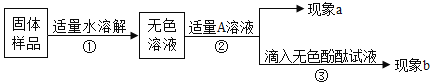
①氢氧化钠变质的原因是___________________(用化学方程式表示);
②若现象a为有气泡产生,则加入的A溶液可能是__________,说明氢氧化钠已经变质,写出产生气泡的反应的化学方程式_______________。
③进一步探究固体变质的程度,若加入的A是过量的CaCl2溶液(CaCl2溶液呈中性),现象a为__________,现象b为_________,则证明该氢氧化钠固体部分变质,写出发生反应的化学方程式_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】我省有漫长的海岸线,蕴藏着丰富的海洋资源
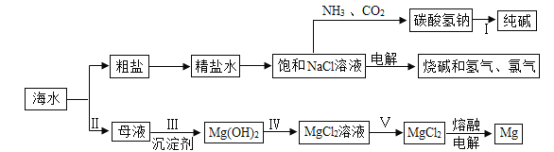
(1)海水晒盐:
①海水“晒盐”是利用__________(填字母代号)的方法使NaCl晶体析出。
A升高温度,使NaCl溶解度增大
B风吹日晒,使溶剂蒸发
②海水“晒盐”后,所得的母液是氯化钠的________溶液(填“饱和”或“不饱和”)。
(2)粗盐提纯:除去难溶性杂质后的食盐水中还含有Ca2+、Mg2+、SO42-等杂质离子,为得到较纯的氯化钠,进行如下的实验操作:①加入过量的Na2CO3溶液 ②加入过量的BaCl2溶液 ③加入过量的NaOH溶液 ④加入适量的盐酸调节溶液的pH等于7 ⑤过滤 ⑥蒸发。下列操作顺序正确的是______(填字母)。
A①③②④⑤⑥
B②③①④⑤⑥
C③①②⑤④⑥
D②③①⑤④⑥
其中操作①加入过量的Na2CO3溶液,可除去的溶液中的离子是______(填离子符号),④加入适量的盐酸调节溶液的pH等于7的目的是__________。
(3)海水制镁:实际生产中,步骤Ⅲ常选用__________(填化学式)作为沉淀剂,写出该反应的化学方程式__________________,从海水中提取MgCl2历经步骤Ⅲ、IV、V三步转换的主要目的是______________。
(4)海水“制碱”:氨碱工业生产过程中,在加压并不断向饱和的氨盐水中通入二氧化碳气体,_______(填化学式)先结晶析出,原因是______________,写出步骤I的化学方程式________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图为甲、乙两种固体在水中的溶解度曲线。下列说法正确的是( )
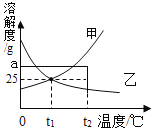
A. 甲物质的溶解度比乙物质的大
B. t2℃时,ag甲溶于100g水形成甲的不饱和溶液
C. t1℃时,甲、乙的饱和溶液溶质的质量分数都是25%
D. 将t1℃时甲和乙的饱和溶液升温至t2℃,仍然都是饱和溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】我们通过学习知道,钠原子在化学反应中易失去电子,成为钠离子.
(1)“在金属活动顺序里,位于前面的金属能把位于后面的金属从其盐溶液里置换出来”,金属钠排在金属铜的前面。有的同学据此推测:钠能从蓝色硫酸铜溶液中把铜置换出来。
教师按照下列顺序进行演示实验,并记录实验现象:
步骤一:将硫酸铜溶液倒入培养皿中
步骤二:用镊子将一小块金属钠放入培养皿中
现象1:金属钠成小球状在液体表面游动
现象2:金属小球逐渐变小至消失,在小球游动的轨迹下面只有蓝色絮状难溶物出现
①由以上实验现象得出结论:因为反应中没有____色的物质 生成,所以金属钠_____________________(填:“能” 或“不能”)把铜从硫酸铜溶液中置换出来。
②对实验涉及的物质进行分析:硫酸铜溶液中溶剂为水,溶质为_______________(填化学式),钠与硫酸铜溶液反应后培养中皿所含元素有: Na、 Cu、 H、O、______________________ (填元素 符号)五种元素。查阅资料得知:“ 蓝色絮状难溶物”是一种学过的碱,该物质的名称是_________________________。
(2)有的同学又产生新的疑问:钠能否与水发生反应?生成物是什么?教师为解答学生的疑惑,又设计并进行如下实验。同时记录有关现象:
步骤一:向盛有蒸馏水的烧杯中滴入几滴酚酞试液并搅拌均匀
步骤二:用镊子将一小块金属钠放入烧杯中
现象:钠在液体表面成小球状游动并发出“嘶嘶”声响。小球周围有“蒸汽”产生,有时有火星出现,液体中出现红色。
请结合上面所示信息,回答下列问题:
①用手触摸反应后烧杯外壁,感觉烫手,说明钠与水发生的是____ (填:“吸 热”或“放热”)反应。
②从现象中可以断定:液体中出现红色说明反应后液体显_______________________性,结合液体中所含元素,继而推断有_______________________(填化学式)生成。另外,钠与水反应还生成一种可燃性气体单质。请写出钠与水反应的化学方程式:________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】通过化学学习,相信你已经掌握了实验室制取气体的有关知识,请结合下列装置图,回答问题:
(1)写出标号②的仪器名称:________________________。
(2)实验室用高锰酸钾制取氧气,该反应的化学方程式为________________________。在往装置中加入药品之前首先应。试管口要放一团棉花的目的是________________________。
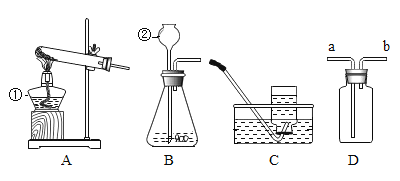
(3)如果用D装置,也采用排水法收集氧气,要预先在瓶中装满水,则氧气由____ (填 “a”或“b”端,下同)端通入。此时如果想测出收集到氧气的体积,可以用的办法是________________________。如果还用上图正放的D装置,采用排空法收集氧气,则氧气由________________________端通入。
(4)天然气的主要成分---------------甲烷,在实验室里可用排水法或向下排空气法收集,请你根据甲烷的收集方法,推测该气体具有的物理性质是_________________________。
(5)实验室用B装置制取氧气时,利用装置C收集气体时,当观察到________, 说明瓶内的氧气已收集满。实验结束后,李小小同学问:“我怎 么知道这气体就是氧气呢?”请你设计验实消除他的疑问:________________________。
(6)要收集到较纯净的氧气,通常应该选用收集装置C,若用该装置收集的氧气也不纯,原因可能是________________________。(写出一条原因即可)
查看答案和解析>>
科目: 来源: 题型:
【题目】通过观察和实验的方法可获知物质的性质,从物质的状态、颜色、温度变化、有无沉淀或气体生成等方面可寻找物质发生变化的证据,分析各种证据能加深对物质变化和变化规律的认识。请回答:
(1)将锌粒放入稀硫酸中,锌粒表面产生气泡,产生该气泡的化学方程式为________________________;该反应的基本类型属于________________________反应。
(2)经引燃的铁丝在氧气中燃烧,支持铁和氧气发生化学反应的最主要证据是________________________;
(3)我国西汉时期,在《淮南万毕术》中记载“曾青得铁则化为铜”,意思是可溶性的铜的化合物与铁发生反应得到单质铜。该反应证明了铁的金属活动性比铜________________________。 某大型工厂利用此原理处理含硫酸铜的废液回收金属铜时,向100kg 的废液中加入足量的铁粉,得到金属铜6.4kg,那么废液中硫酸铜的质量分数是________________________。
(4)铁是应用广泛的金属,但每年因锈蚀而报废的数量也相当惊人。请写出你所知道的一种防止铁制品生锈的方法:________________________。(写出 一种即可)
查看答案和解析>>
科目: 来源: 题型:
【题目】研究物质的溶解对于生产、生活有着重要意义。
下面表一是硝酸钾的部分溶解度数据。
表一:
温度(°C) | 20 | 40 | 60 | 80 |
溶解度(g/100g水) | 31.6 | 63.9 | 110 | 169 |
(1)由上面表一中数据可知硝酸钾的溶解度随温度升高而______________________(选填“变大”或“变小”)。60℃时硝酸钾饱和溶液中,溶质与溶剂的质量比为________________ (最简整数比) ,能将该饱和溶液转化为不饱和溶液的一种方法是_________________(写出一种即可)
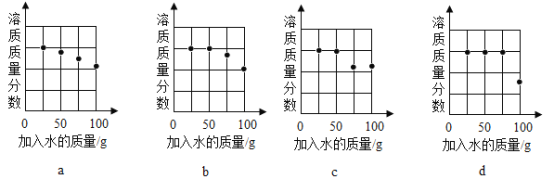
(2)探究20℃时配制硝酸钾溶液过程中,溶质质量分数与加入水的质量关系。
向硝酸钾中分批加水,充分搅拌,现象如下图所示:

下列坐标图中,符合实验结果的描点可能是______________________________ (选填编号) 。
(3)取等质量甲和乙两种物质(均不含结晶水)进行如图所示实验,最终烧杯中析出固体的质量甲小于乙。
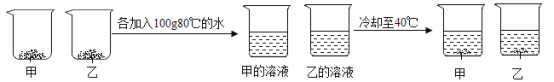
则40℃时,甲的溶解度___________ (选填 “大于”“等于”或“小于”)乙的溶解度,根据本实验结果能否判断40℃~80℃间,甲、乙哪种物质的溶解度变化受温度影响更大___ (选填“能”或“不能”)。
(4)根据表一的数据,20℃时,将50gKNO3固体放入100g 水中充分溶解,所得溶液中溶质的质量分数为________________________; (计算结 果精确到0.1%).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com