
科目: 来源: 题型:
【题目】A、B、C、D、E为初中化学常见的物质,其中A、C为金属单质,E为非金属单质,如图是它们之间的相互转化关系.请回答:
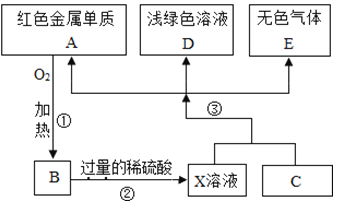
(1)反应①的基本反应类型是_____;其反应的化学方程式_____;
(2)C的化学式为_____;
(3)写出物质E和B在加热条件下反应的化学方程式_____
(4)转化中产生无色气体E的原因是_____.
查看答案和解析>>
科目: 来源: 题型:
【题目】氯化钾和硝酸钾晶体在不同温度时的溶解度如表所示:
温度/℃ 溶解度/g 物质 | 0 | 10 | 20 | 30 | 40 |
KCl | 27.6 | 31.0 | 34.0 | 37.0 | 40.0 |
KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 |
(1)30℃时,硝酸钾的溶解度为_____;
(2)等质量这两种物质的饱和溶液从40℃降温到10℃时析出晶体更多的是_____;
(3)若两种物质的溶解度相等,此时所对应的温度范围在_____之间;
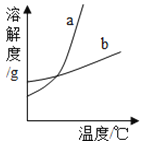
(4)如图中能表示KCl溶解度曲线的是(填“a”或“b”)_____.
查看答案和解析>>
科目: 来源: 题型:
【题目】生产、生活中常需配制溶液.

(1)配制一瓶如图所示溶液需氯化钠_____g.
(2)配制一定质量分数的氯化钠溶液时,下列哪些操作会导致溶液的质量分数偏小______?请说明偏小的原因________________________。
①用量筒量取水时仰视读数;
②往烧杯中加水时有水溅出;
③称量含不溶性杂质的氯化钠来配制溶液;
④将配制好的溶液往试剂瓶中转移时有少量溅出.
查看答案和解析>>
科目: 来源: 题型:
【题目】2018年5月18日我国第一艘国产航母试海成功,航母的许多电子元件使用了黄铜。为测定某黄铜(假设合金中仅含铜,锌)中铜的质量分数,兴趣小组同学称取20g黄铜粉末于烧杯中,将80g稀硫酸分四次加入,充分反应,测得实验数据如下表所示:
第一次 | 第二次 | 第三次 | 第四次 | |
加入稀硫酸的质量(g) | 20 | 20 | 20 | 20 |
烧杯中剩余物的质量(g) | 39.92 | 59.84 | 79.80 | 99.80 |
(1)黄铜粉末完全反应生成氢气的总质量为_______g。
(2)该黄铜中铜的质量分数为多少____________? (写出计算过程)
(3)第三次实验中溶质的种类为________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是甲、乙两种固体的溶解度曲线。下列说法中不正确的是
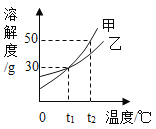
A.![]() ℃时,甲和乙的溶解度相等
℃时,甲和乙的溶解度相等
B.![]() ℃时,30g乙加到100g水中形成饱和溶液
℃时,30g乙加到100g水中形成饱和溶液
C.![]() ℃时,各100g饱和溶液降温到
℃时,各100g饱和溶液降温到![]() ℃析出固体甲多于乙
℃析出固体甲多于乙
D.![]() ℃时,75g甲的饱和溶液中加100g水得到20%的溶液
℃时,75g甲的饱和溶液中加100g水得到20%的溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】宏观辨识和微观剖析是化学核心素养之一。下列说法正确的是 ( )
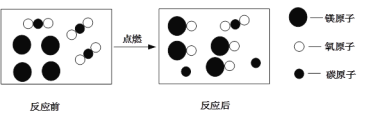
A. 反应前后元素的种类及化合价均未发生改变
B. 参加反应的![]() 和
和![]() 的微粒个数比是4:3
的微粒个数比是4:3
C. 反应涉及到的物质中,![]() 是由原子构成的单质,只有
是由原子构成的单质,只有![]() 属于氧化物
属于氧化物
D. 该反应生成的单质和化合物的质量比时3:20
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组为测定某黄铜样品(铜锌合金)中铜的含量,进行如图所示的实验。根据以下信息回答下列问题:

(1)写出实验中发生反应的化学方程式_____;
(2)根据已知条件列出求解生成硫酸锌质量(X)的比例式_____;
(3)该黄铜样品中铜的质量分数为_____;
(4)若要使所得滤液中溶质的质量分数为10%,需加入水的质量为_____;
(5)若用98%的浓硫酸配制所用的稀硫酸,则需要浓硫酸的质量为_____;
(6)若工业上用含Cu2S 80%的辉铜矿111t(炼制过程中辉铜矿的损失率为20%),能炼出上述黄铜的质量为_____。
查看答案和解析>>
科目: 来源: 题型:
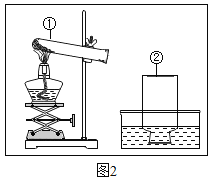
【题目】实验室现有大理石、高锰酸钾、稀盐酸、二氧化锰及相关的仪器。

(1)请选择合适的仪器制备二氧化碳并验证,需要补充一种药品名称是_____,若制取另一种气体,需要在试管口放置一种用品,该用品的作用是_____。
(2)写出制取气体单质的化学方程式为_____;
(3)检查装置气密性时,将试管和带导管的胶塞连接好后,先将导管一端_____,用_____,观察水中有没有气泡冒出。若观察到有气泡冒出证明装置气密性良好,试管回复室温后导管内出现水柱,这是因为开始时受热试管内气体膨胀逸出,回复室温后由于试管内气体_____压强_____在压强差的作用下,形成一段水柱。
(4)请你将图2实验装置图补充完整_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】如今,走向“地铁、高铁时代”的中国,正大力发展电气化铁路。高铁的运行为我们的出行提供了方便。中国的高铁技术不仅服务于中国,也终将造福于全人类。请试着回答下列问题:

(1)地铁、高铁的车身具有密度小,抗腐蚀性好的性质,应选择的合金_____;(在A、B、C中选填)
A 锰钢 B 铝合金 C 不锈钢
(2)高铁在工作过程中的能量转化为_____;
(3)高铁运行时的接触材料用铜及铜合金线,而火法炼铜是当今生产铜的主要方法。其中重要的一步是用氧化亚铜(Cu2O)和硫化亚铜(Cu2S)高温反应生成高纯度的铜和一种气态空气污染物,则发生反应的化学方程式是_____,该反应前后铜元素的化合价变化为_____。
(4)地铁的建成将大大缓解城市的交通压力并保护环境,将减少汽车污染物的排放,如一氧化碳、未燃烧的碳氢化合物、_____、含铅化合物、_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E、F分别是铁粉、稀盐酸、二氧化碳、氧气、硫酸铜溶液、碳酸钙中的一种物质.如图用圆表示这六种物质,用“一”表示两种物质可以发生化学反应.用表“→”示一种物质能转化为另一种物质.请回答下列问题:
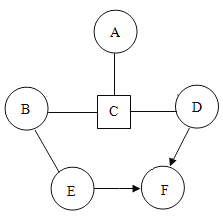
(1)在图中标出六种物质的化学式;______
(2)写出物质间两两反应生成气体的化学方程式为______;
(3)A与C反应的实验现象为______.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com