
科目: 来源: 题型:
【题目】稀土金属是我国战略性资源,应加以保护。稀土金属钇(Y)是很活泼的金属,常见化合价为+3价,它是激光和超导的重要材料。
以钇矿石(Y2FeBe2Si2O10) 为原料生产氧化钇(Y2O3) 的主要流程如下:
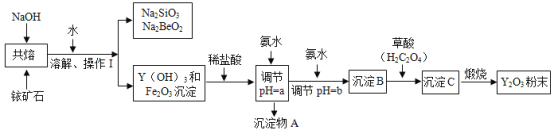
资料卡:有关金属离子形成氢氧化物沉淀时的pH如下表:
开始沉淀时的pH | 完全沉淀时的pH | |
Fe3+ | 2.7 | 3.7 |
Y3+ | 6.0 | 8.2 |
(1)钇矿石与NaOH共熔前粉碎的目的是_____________________。
(2)操作Ⅰ是_________,需要的玻璃仪器有____________________。
(3)加盐酸时,发生中和反应的化学方程式为:____________________。
(4)调节pH=a,则a应控制在__________________的范围内。
(5)沉淀C是草酸钇,其化学式为____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图中ABCD分别为不同类别的无机化合物,其中B是一种常见的食品干燥剂,C、 E属于同类物质,F的溶液为黄色且能与硝酸银溶液反应,产生不溶于稀硝酸的白色沉淀。(“→”表示物质之间的相互转化关系,“一”表示两端的物质能发生化学反应)
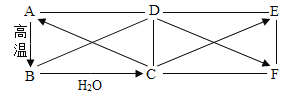
(1)根据推断写出以下两种物质的化学式:A:____________;F:_____________。
(2) D与C的反应属于____________反应(填基本反应类型)。
(3)写出反应C→E的化学方程式:__________________________。
(4)写出D物质的一种用途__________________________。
(5) E溶液与F溶液反应的现象是__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】开发海洋,维持海洋的可持续发展是每个公民的职责。请回答下列问题:
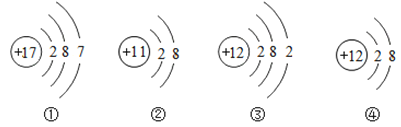
(1)海水中含量最多的金属阳离子是__________ (填符号,下同), 含量最多的分子是___________。
海水中除含有大量的氯化钠外,还有氯化镁、氯化钙等物质,则下图微粒结构示意图所表示的粒子一定在海水中含有的是______________(填序号)。
(2)粗盐经过溶解、过滤后所得的氯化钠溶液中经常含有MgCl2、CaCl2、 Na2SO4 杂质。除去杂质所加的三种试剂: NaOH溶液、Na2CO3 溶液、BaCl2 溶液(均过量)。其加入顺序要求是: Na2CO3溶液必须在BaCl2溶液之____________(填“前”或“后”) 加入。加入Na2CO3溶液的目的是:__________________。
(3)某学生制作了一种家用环保型消毒液发生器,原理是电解饱和氯化钠溶液。
请将化学方程式补充完整: 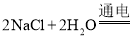 ________
________ ![]() 。
。
(4)某实验小组配制11%的氯化钠溶液100g,具体的称量与量取操作如图所示。
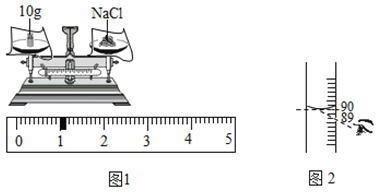
①图1中实际称得氯化钠质量为________________g,图2中实际量取蒸馏水体积为__________mL ;
②根据图1、图2操作,其他各步操作均规范无误,实际配得的氯化钠溶液的溶质质量分数是__________(精确至0.1%)。
③写出该实验中正确称量氯化钠的操作过程:______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】金属在生产、生活中应用广泛。
(1)在汽车电路中,经常用铜作导线,这是利用了铜的____________。汽车车体表面喷漆不仅美观,而且可有效防止与___________接触而生锈。
(2)铝和氧化铁在高温下发生置换反应,放出大量的热,工业上常利用此反应焊接铁轨。该反应的化学方程式为_________________________。
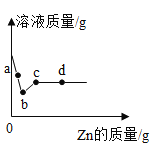
(3)向一定质量AgNO3和Cu(NO3)2的混合溶液中加入Zn,溶液质量与加入Zn的质量关系如图所示,(填化学式) 则c点溶液中的溶质为_________________;d点所得固体为___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】合成氨是人类科学技术上的一项重大突破,也是化学对社会发展与进步做出的巨大贡献。合成氨的流程图为:
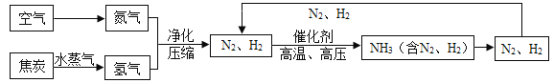
(1)制取氢气的反应为: 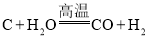 ,反应前后化合价发生变化的元素是________________(填元素符号)。
,反应前后化合价发生变化的元素是________________(填元素符号)。
(2)写出N2、H2反应生成NH3的化学方程式_______________________。
(3)流程图中将N2、H2 循环使用,目的是______________________。
(4)将沸点不同的气体分离开来,常采用液化分离法。如:控制温度在- 183°C时,可将空气中N2与O2分离。根据下表中物质的沸点判断,要将产物NH3与N2、H2分离开来,最适宜的温度应该控制在__________。
物质 | H2 | N2 | O2 | NH3 |
沸点 | -252°C | -195.8°C | -183°C | -33.35°C |
(5) 在一定条件下,A、B能发生化学反应生成C和D,其微观示意图如下
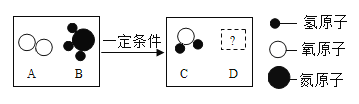
若D为空气中体积分数最大的气体,则反应中C和D的化学计量数之比为______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】汽车尾气三效催化剂表面物质转化的关系如右下图所示,下列说法错误的是 ( )
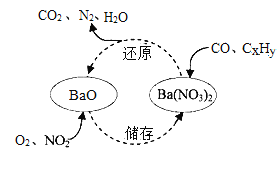
A.储存过程发生了化合反应
B.该过程能减缓温室效应和酸雨污染
C.还原过程中CxHy生成的CO2和H2O质量比为22 : 9,则x: y=1:2
D.整个转化过程中有机物除外的化学方程式可表示为: 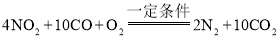
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学利用图甲所示装置测定空气中氧气的含量,其中燃烧匙内的白磷用电加热装置点燃,瓶内气压用气体压强传感器测定,其变化如图乙所示。则下列分析合理的是( )
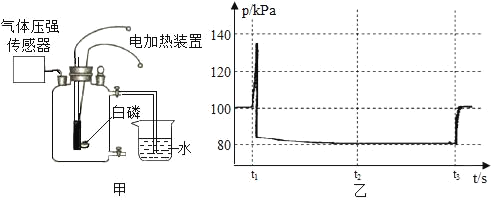
A. t1时刻后的一段时间能观察到白磷燃烧产生大量白色烟雾
B. 从瓶内气压达到最高点直至t2时刻,瓶内温度始终保持不变
C. 根据t2时刻瓶内的气压值,可以计算出氧气占空气体积的百分比
D. t3时刻后的一段时间内瓶内气压又显著增加,其原因是温度又升高了
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组用青霉素的药瓶、注射器和眼药水瓶设计了如图所示的实验装置,用于检验二氧化碳的性质。缓缓推动注射器活塞,滴入稀硫酸后,在眼药水瓶中即可产生二氧化碳气体,下列有关说法错误的是

A. 该实验中不能用浓盐酸代替稀硫酸
B. 上下两片滤纸条变红,只能证明CO2与水反应生成碳酸
C. 该实验能验证二氧化碳不能燃烧,也不支持燃烧
D. 该微型实验具有所用药品量少,现象明显,操作简单等优点
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)在化学课上,甲同学将燃烧的钠迅速伸人到盛有CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底附着黑色颗粒,瓶壁上粘附着白色物质。
[提出问题]黑色颗粒和白色物质是什么?
[进行猜想]甲认为黑色颗粒是碳,白色物质可能是Na2O或Na2O和Na2CO3或____________________,乙同学还认为白色物质是氢氧化钠。
甲同学立刻认为乙同学的猜想是错误的,其理由是____________________________________。
[查阅资料]氧化钠为白色粉末,溶于水生成氢氧化钠: ![]() ;常温下饱和Na2CO3溶液的PH值约为12。
;常温下饱和Na2CO3溶液的PH值约为12。
[实验探究]甲同学对白色物质进行实验探究。
实验方案 | 实验操作 | 实验现象 | 结论 |
方案1 | 取样品少量于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 | 溶液变成红色 | 白色物质为Na2O |
方案2 | ① 取样品少量于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2 溶液 | 出现白色沉淀 | 白色物质是Na2CO3 |
② 静置片刻,取上层清液于试管中,滴加无色酚酞试液 | 无明显现象 |
[反思评价]丙同学认为方案1得到的结论不正确,其理由是___________________________。
[得出结论]钠在二氧化碳中燃烧的化学方程式为__________________________。
(2)某研究性学习小组设计了用沉淀法测定纯碱( Na2CO3)样品(只含NaCl杂质)中Na2CO3质量分数的实验方案
[实验原理]利用碳酸根离子与钙离子结合生成沉淀,通过沉淀的质量而得出碳酸钠的质量分数
[实验步骤]
①托盘天平称取样品22.0g放人烧杯中,加水使其完全溶解
②验证Na2CO3已完全反应的方法是:静置,向上层清液中滴加____________溶液,如果没有白色沉淀生成,即可证明;
③过滤、操作X、干燥、称量沉淀的质量为20.0g,操作X的名称是___________,如果缺少此操作会造成碳酸钠质量分数___________(填“偏高”“偏低”或“不变”)。
④通过以上提供的数据计算出样品中碳酸钠的质量分数为多少?_____
查看答案和解析>>
科目: 来源: 题型:
【题目】H2是一种重要化工生产原料,也是一种极具开发前景的清洁能源。实验室常用锌粒与稀硫酸来制取H2,以便研究H2的性质,下面是一些常见的化学仪器或装置,请按要求填空:
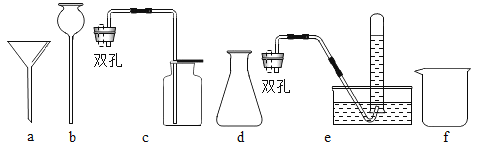
(1)写出上述仪器的名称:b___________,f________;
(2)选取上述仪器中的_______(填字母代号)组装成制备和收集H2的装置;
(3)为安全起见,在点燃氢气之前,必须进行的操作是________________________;
(4)此套制备H2的装置_______(填 “能”或“不能”)制备O2,如果能,请写出用其制备O2反应的化学方程式;如果不能,说明理由:_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com