
科目: 来源: 题型:
【题目】茶氨酸(C7H14O3N2)具有降低血压、提高记忆力、保护神经细胞、减肥等功效。下列说法正确的是
A.茶氨酸属于无机化合物
B.茶氨酸由26个原子构成
C.茶氨酸中碳元素的质量分数约为48.3%
D.茶氨酸中碳、氢、氧、氮各元素的质量比为7:14:3:2
查看答案和解析>>
科目: 来源: 题型:
【题目】某实验小组的同学对“锌与硫酸反应速率的影响因素”进行探究,并利用如图装置收集产生的氢气。
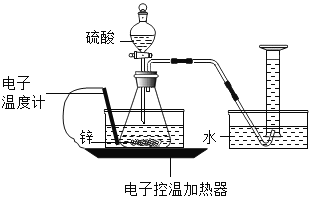
(查阅资料)
圆粒状锌的直径通常为 3-4 毫米,粉末状锌的直径通常为 0.3-0.5 毫米。
(进行实验)
实验 1:在不同温度下,进行锌与硫酸反应的实验。
编号 | 温度/℃ | 硫酸体积/ mL | 硫酸溶质质量分数 | 锌的形状 | 锌的质量 /g | 收集30mL氢气所用的时间/s |
1-1 | 20 | 20 | 10% | 圆粒状 | 1 | 170 |
1-2 | 30 | 20 | 10% | 圆粒状 | 1 | 134 |
1-3 | 40 | 20 | 10% | 圆粒状 | 1 | 107 |
实验 2:在相同温度下,继续进行锌与硫酸反应速率的影响因素的探究。
编号 | 温度/℃ | 硫酸体积/ mL | 硫酸溶质质量分数 | 锌的形状 | 锌的质量 /g | 收集30mL氢气所用的时间/s |
2-1 | 20 | 20 | 10% | 圆粒状 | 1 | 170 |
2-2 | 20 | 20 | 10% | 粉末状 | 1 | 47 |
2-3 | 20 | 20 | 20% | 圆粒状 | 1 | 88 |
2-4 | 20 | 20 | 20% | 粉末状 | 1 | 26 |
(解释与结论)
(1)锌与硫酸反应的化学方程式为_____ 。
(2)能用排水法收集氢气的原因是氢气_____(填“易”或“难”)溶于水。
(3)实验 1 的目的是_____。
(4)实验 2 中,欲得出“其他条件相同时,硫酸的溶质质量分数越大,锌与硫酸反应的速率越快”的结论,需要对比的实验_____(填编号)。
(5)实验 2 中,通过对比 2-1 和 2-2,得出的结论是_____。
(反思与评价)
(6)实验室制取氢气时,通常使用锌粒而不用锌粉的原因为_____。
(7)实验室中若使用 6.5g 锌粒制取氢气,理论上制得氢气的质量为_____g。
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化碳的性质实验如下图所示。
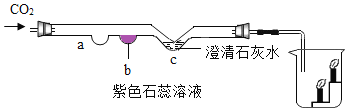
(1)实验过程中,b 处的实验现象是_____,若要证明二氧化碳与水反应,应在 a 处放_____。
(2)c 处的化学方程式为_____。
(3)烧杯中观察到的实验现象是_____,得出的结论是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】粗盐提纯的主要操作如下图所示。
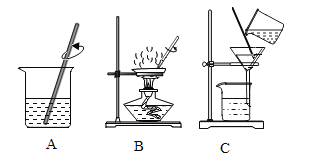
(1)实验正确的操作顺序是 _____(填序号)。
(2)蒸发过程中有固体析出时,食盐水是 _____溶液(填“饱和”或“不饱和”)。
(3)称量精盐质量时,将精盐放在托盘中的纸上,天平指针偏左,合理的操作是 _____。
(4)下列说法不正确的是 _____。
A 溶解和过滤过程中玻璃棒的作用相同
B 蒸发过程中待溶液全部蒸干时停止加热
C 过滤后得到的滤液为纯净物
(5)举出生活中利用过滤原理的例子 _____。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图为电解水的装置。通电前,为增加导电性加入了少量的硫酸钠,再加入酚酞溶液,溶液呈无色。
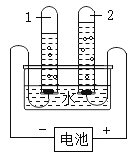
(1)通电一段时间后,试管 1 中的水溶液呈红色,说明试管 1 中的溶液PH_____ 7(填“大于”“小于”或“等于”);试管 1 中的气体是 _____。
(2)电解水的化学方程式为_____ 。
(3)检验正极产生的气体的方法是_____。
(4)氢气作为新能源,其主要优点是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下图回答问题。
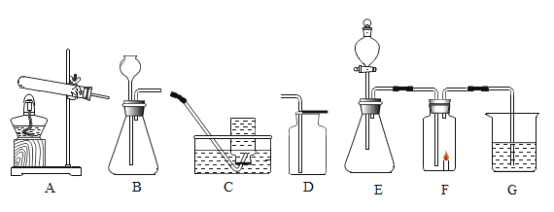
(1)用高锰酸钾制取氧气时,若要收集较为纯净的氧气,所选用的收集装置是_____(填字母),用该装置收集氧气的原理是_____,A 中试管口放一团棉花的原因是_____。
(2)用连接好的 E、F、G 装置做实验,若 F 中的蜡烛燃烧更旺,则装置 E 中发生反应的化学方程式是 _____。G 中的液体用来检验蜡烛燃烧的产物之一,则 G 中盛放的是_____, 观察到的现象是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验小组做了如下图所示实验。
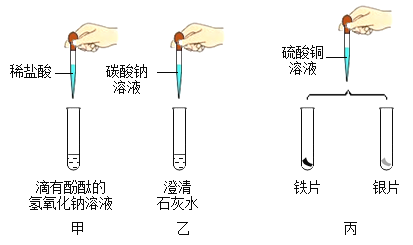
(1)能证明甲中发生反应的现象是_____。
(2)乙中可观察到的现象是_____,发生反应的化学方程式为_____。
(3)丙中观察到的现象为_____, 由该实验现象推断,三种金属活动性由强到弱为_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】现代工业常以氯化钠为原料制备纯碱,部分工艺流程如下:
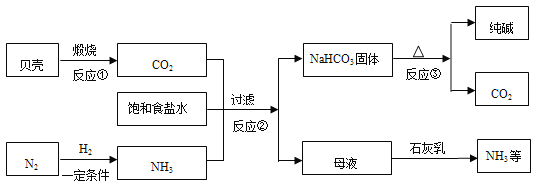
已知:贝壳的主要成分是CaCO3,反应②的化学方程式为:NaCl(饱和溶液)+NH3+H2O+CO2=NH4Cl+NaHCO3↓
(1)反应①的另一种产物是配制石灰乳的主要原料之一,配制石灰乳时发生反应的化学方程式为_____________。
(2)反应③的基本反应类型是_______,反应的化学方程式为________________。
(3)母液中含有的溶质是________。
(4)整个生产过程中可循环利用的物质是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com