
科目: 来源: 题型:
【题目】(1)生产电脑芯片的材料主要是高纯硅,工业生产硅的原理为 2C+SiO2  Si+2CO↑,在反应中,SiO2发生了 _____(填“氧化”或“还原”)反应,该反应生产的是粗硅,将粗硅提纯才能得到高纯硅,在提纯过程中发生的反应之一是:H2+SiCl4
Si+2CO↑,在反应中,SiO2发生了 _____(填“氧化”或“还原”)反应,该反应生产的是粗硅,将粗硅提纯才能得到高纯硅,在提纯过程中发生的反应之一是:H2+SiCl4  HCl+X,X 的化学式为_____;
HCl+X,X 的化学式为_____;
(2)使用硬水会给生活和生产带来许多麻烦,如用硬水洗涤衣物,既浪费肥皂也洗不净衣物,下列方法中,可以有效降低水的硬度的是_____(填序号)。
A 将水煮沸 B 过滤 C 加明矾净化水
查看答案和解析>>
科目: 来源: 题型:
【题目】2018年5月18日我国第一艘国产航母试海成功,航母的许多电字元件使用了黄铜。为测定某黄铜(假设合金中仅含铜,锌)中铜的质量分数,兴趣小组同学称取20g黄铜粉末于烧杯中,将80g稀硫酸分四次加入,充分反应,测得实验数据如下表所示:
第一次 | 第二次 | 第三次 | 第四次 | |
加入稀硫酸的质量(g) | 20 | 20 | 20 | 20 |
烧杯中剩余物的质量(g) | 39.92 | 59.84 | 79.80 | 99.80 |
(1)黄铜粉末完全反应生成氢气的总质量为____________g。
(2)该黄铜中铜的质量分数为多少?(写出计算过程)____________
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室有一瓶化肥的标签已脱落,只知道它是NH4Cl、(NH4)2SO4、NH4HCO3和尿素[CO(NH2)2]中的一种。请你完成以下探究:
(猜想)猜想①:该化肥是NH4Cl,
猜想②:该化肥是 ,
猜想③:该化肥是NH4HCO3,
猜想④:该化肥是尿素。
(实验探究)
(1)取少量样品在研钵中与熟石灰研磨,有刺激性气味的气体放出,证明猜想 不成立;写出其中一种化肥发生该反应的化学方程式: 。
(2)如(图1),另取少量样品于试管中,滴加适量水振荡,再选(图2)中 溶液滴入试管中,若无气泡放出,则猜想 不成立。
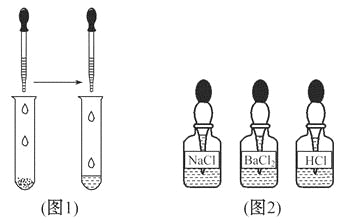
(3)在步骤(2)的试管中再滴入(图2)中的 溶液,若 ,则猜想①成立;若 ,则猜想②成立,其反应的化学方程式为 。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是a、b、c三种物质的溶解度曲线,下列说法正确的是( )

A.a的溶解度大于b的溶解度
B.c一定是熟石灰的溶解度曲线
C.三种物质的饱和溶液分别从t2℃降温至t1℃,a、b析出的晶体质量相等
D.n点说明了在t2℃时,a、b两种物质的饱和溶液溶质质量分数是相同的
查看答案和解析>>
科目: 来源: 题型:
【题目】长久使用热水壶底部有层水垢,主要成分为CaCO3和Mg(OH)2,某学校化学研究小组的同学通过实验测定水垢中CaCO3的含量:将过量的稀盐酸加入到200g水垢中,把产生的CO2气体用足量的NaOH溶液吸收,同时测量3min钟内NaOH溶液增加的质量,结果如下表:
时间/s | 0 | 30 | 60 | 90 | 120 | 150 | 180 |
质量/g | 0 | 30 | 50 | 60 | 66 | 66 | 66 |
(1)写出CO2被足量的NaOH溶液吸收时,发生的化学反应方程式_______________。
(2)从表格中可以看出,200g水垢与盐酸反应生成的CO2最多是___________g。
(3)计算水垢中碳酸钙的质量分数,写出计算过程_________
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究性学习小组欲利用下列装置进行相关气体的制取,请你分析并填空。
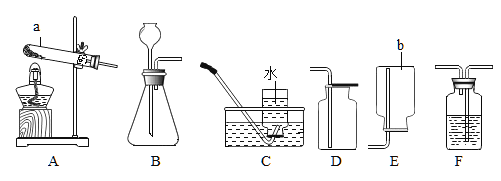
(1)写出仪器a和b的名称:a_________,b__________。
(2)实验室制取并收集二氧化碳,应选用的装置为______________(填字母),若用F装置干燥二氧化碳气体,F中应加入的试剂是_____________________。
(3)实验室用高锰酸钾制取氧气,该反应的化学方程式为_____,氧气验满的方法为____。
查看答案和解析>>
科目: 来源: 题型:
【题目】氢气是一种理想的新能源,具有广阔的开发前景。铁酸锌(ZnFe2O4)可用于循环分解水制氢气,其反应可表示为:
![]() ;
;![]()
(1) ZnFe2O4中Fe的化合价为___________。
(2)该循环制氢中不断消耗的物质是___________。
(3)氢气作为新能源,有不污染环境、热值大、原料来源丰富等优点,但目前并没有被广泛应用,你认为主要原因是_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】燃料的使用为我们的生活提供了方便,工人师傅使用氧炔焰进行金属切割或金属焊接,氧炔焰是乙炔(C2H2)跟氧气发生燃烧反应产生的火焰,回答下列问题:
(1)乙炔属于___________(填“有机物”或“无机物”) 。
(2)已知乙炔完全燃烧时生成二氧化碳和水,请写出其燃烧的化学方程式___________。
(3)实验室用电石(CaC2)与水反应制取乙炔,电石与水的反应比较剧烈,为了得到平稳的乙炔气流,实验时常用饱和食盐水代替水,并用___________(填仪器名称)控制滴加速率,使用__________(填“块状”或“粉末状”)电石固体。
查看答案和解析>>
科目: 来源: 题型:
【题目】溶解度是我们初中化学常见的概念,请回答下列问题。
I.下表是NaC1、KNO3在不同温度下的溶解度:
温度/℃ | 0 | 20 | 40 | 60 | 80 | |
溶解度/g | NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 |
KNO3 | 13.3 | 31.6 | 63.9 | 110 | 169 | |
(1)要比较NaC1、KNO3在水中的溶解能力,需要控制的变量是水的质量和_____________________。
(2)从KNO3溶液中获取其晶体适宜的方法是_____________________。
(3)20℃时,各取NaC1、KNO3固体3.5g加入10g水中,充分溶解后达到饱和状态的是___溶液。
(4)若将上述数据在坐标中绘制成NaCl、KNO3的溶解度曲线,两条曲线的交,点对应的温度范围是(_____)
A 0°C~20°C
B 20°C ~40°C
C 40°C ~60°C
D 60°C ~80°C
II.将质量为30g的B物质加入到50g水中,充分搅拌后,剩余物质的质量随温度的关系如图所示,过程中不考虑水分蒸发,回答问题:

(5)固体B的溶解度随温度的升高而____________(填“增大”或“减小”) 。
(6) t1℃时,B的溶解度是___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】金属及金属材料有很多优良的性能而被广泛应用。
(1)铁制炊具加热食物,说明铁具有的性质是_____________________。
(2)铝制品比铁制品耐用,其原因是____________________。
(3)钛合金因为优良的性能,被广泛应用于生物医学、航空航天等领域,钛合金的优点有________________(任写一条),构成金属钛的粒子是________________(填“分子”“原子”或“离子”) 。
(4)合金Mg2Cu是一种潜在的贮氢材料,高温时在氩气保护下,由一定质量比的Mg、Cu单质熔炼获得。
①熔炼制备Mg2Cu合金时,通入氩气的目的是____________________。
②将11.2g 的Mg2Cu合金与过量盐酸反应,生成氢气的质量为___g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com