
科目: 来源: 题型:
【题目】为了探究金属与酸反应的规律,某实验小组进行了如下实验,取等质量的铁片、镁片、锌片,分别与等体积、等浓度的稀盐酸反应,用温度传感器测得反应温度变化曲线如下图所示。
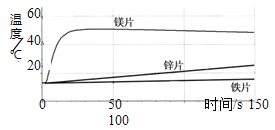
(1)请分析反应中温度升高的原因:_________________ ;
(2)根据曲线总结出金属活动性的相关规律:__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学革命是发生在十八世纪末英国和法国的一场深刻的化学学科的变革。英国物理学家、化学家波义耳和法国化学家拉瓦锡曾做过貌似相同的两个实验(见图)。
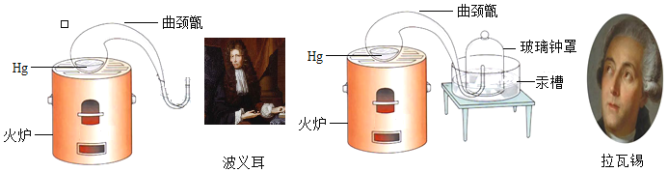
关于这两个实验的说法正确的是( )
A. 两个实验都可用于测定空气中氧气的含量
B. 两个实验中,曲颈甑内汞的表面都变为黑色
C. 波义耳的实验中,金属加热后质量增加,该现象不能用质量守恒定律解释
D. 拉瓦锡的实验中,玻璃钟罩内液面逐渐上升,达到一定高度后不再变化
查看答案和解析>>
科目: 来源: 题型:
【题目】某兴趣小组用如图装置进行实验时发现,烧杯中饱和石灰水先变浑浊,后逐渐澄清。
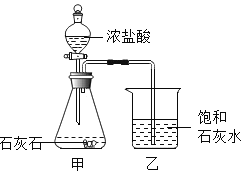
(1)石灰水变浑浊是因为生成了__________。(填化学式)
(2)为探究“饱和石灰水浑浊后变澄清的原因”,该小组同学开展了如下活动:
(查文献)碳酸钙(碳酸钠等)与二氧化碳、水反应生成可溶于的碳酸氢钙(碳酸氢钠等)
(提出假设)假设 1:挥发出的HCl使浑浊变澄清;
假设 2:____________________________________________。
(设计实验)为除去 CO2中的 HCl,小华在甲、乙装置之间增加如图装置, 装置的连接顺序是甲→______→_______→乙(填字母序号);其中存放的试剂合理是________(填选项序号)。
A 浓硫酸 B NaOH 溶液 C 饱和Na2CO3溶液 D 饱和NaHCO3溶液
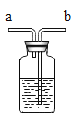
(现象)饱和石灰水浑浊后,继续通入足量 CO2 ,沉淀部分溶解但最终并未完全澄清。
(得出结论)由以上探究可得出结论是____________________________。
(3)该兴趣小组在老师指导下,用pH传感器测得烧杯中溶液的 pH 随通入时间的变化曲线如图。
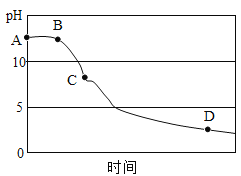
①AB 段pH值不变的可能原因是_______;D点所得溶液的成分除 H2O外还有______。
②BC 段发生的化学方程式主要有________________________。
查看答案和解析>>
科目: 来源: 题型:
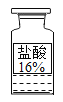
【题目】测定实验中使用的标有质量分数为16%的盐酸如图的实际质量分数。
(1)为了测定,需配制20%的氢氧化钠溶液100g。配制步骤有:①溶解 ②计算,需氢氧化钠____g,需要水_______mL③装瓶并贴标签 ④称取氢氧化钠,其正确的顺序为_____________(填序号)。配制氢氧化钠溶液时,需要的玻璃仪器有量筒、烧杯、滴管及_______________。
(2)小明同学在烧杯中加入配得的氢氧化钠溶液20g,再逐滴加入该盐酸。用pH测定仪测定滴加过程中溶液的pH。下图为测定仪打印出的滴加盐酸的质量与溶液pH的关系图。
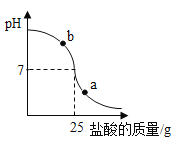
①a点对应的溶液呈_______(填“酸性”、“碱性”或“中性”);b点对应的溶液中的溶质为__________(写名称)。
②请以此次测定的数据,计算该盐酸的实际质量分数为________
查看答案和解析>>
科目: 来源: 题型:
【题目】氢氧化钡与氢氧化钙同属于碱类物质,其化学性质相似吗?某兴趣小组的同学对此进行探究。
Ⅰ.定性探究
序号 | 操作 | 现象 | 结论 |
实验一 | 向氢氧化钡溶液中滴入_____试剂 | 溶液变红 | 氢氧化钡溶液呈碱性 |
实验二 | 向实验一的溶液中通入适量的二氧化碳 | 产生_____, 红色消失 | 氢氧化钡溶液能与 二氧化碳反应 |
实验三 | 另取氢氧化钡溶液,滴入一定量 的碳酸钠溶液 | 产生白色沉淀 | 氢氧化钡溶液能与 碳酸钠溶液反应 |
(1)写出实验三中发生反应的化学方程式________________________;
同学们将上述三个实验中反应后的废液都倒入一个烧杯中,过滤后,得到白色沉淀和红色滤液,他们决定对沉淀和滤液进行探究。
探究一:(提出问题)沉淀能否与酸发生反应?
(实验探究)向沉淀中加入足量的稀硫酸,观察到有气泡产生,最终沉淀______________(填“消失”或“不消失”)。
探究二:(提出问题)滤液中除指示剂外,还有哪些溶质?
(作出猜想)①氢氧化钠, ②氢氧化钠、碳酸钠, ③__________________。
(实验探究)
序号 | 操作 | 现象 | 结论 |
实验四 | 取滤液样品于试管中, 加入几滴稀盐酸 | 没有明显现象 | 猜想②不成立 |
实验五 | 取滤液样品于试管中, 加入几滴碳酸钠溶液 | 产生沉淀 | 猜想_____成立 |
(2)有同学提出:实验四的操作存在问题,导致结论不准确,请你改正:___________________________________________________。
(3)小组同学讨论后发现,只用一种溶液做一次实验,就可以验证猜想,该溶液是_____。
Ⅱ.定量探究
向100g氢氧化钡溶液中滴加溶质质量分数为10%的硫酸铜溶液,溶液的导电能力随着硫酸铜溶液的加入发生如图的变化关系。

溶液处于B点时,其中含有的是_____、_____、_____(填微粒符号)。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是a、b、c三种物质的溶解度曲线,据图回答下列问题。
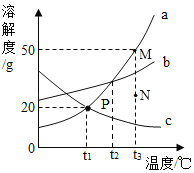
(1)t1℃时,把80g物质a加入到20g水中充分搅拌、静置,形成的是______溶液(填“饱和”或“不饱和”)。
(2)欲使a物质的溶液从M点转化为N点,可采取的措施是_____________。
(3)将P点对应的c物质的溶液升温到t 3℃,其溶质质量分数____(填写“变大”、“变小”或“不变”)。
(4)将t3℃时a、b、c三种物质的饱和溶液恒温蒸发相同质量的水,析出晶体的质量最小的是____(填物质序号)。
(5)t3℃时,将等质量的a、b、c三种物质分别配制成饱和溶液,所得溶液质量由大到小的顺序为___________。
(6)“P”点的意义为___________________________
查看答案和解析>>
科目: 来源: 题型:
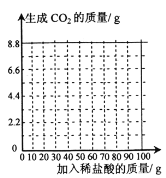
【题目】氢氧化钙久置会逐渐变质为碳酸钙。实验室有一瓶部分变质的氢氧化钙样品,为测定其中碳酸钙的质量分数,取16.2g样品于烧杯中,加足量的水,再将100g稀盐酸逐渐缓慢加入烧杯中并不断搅拌,获得相关数据如下表(提示:氢氧化钙先与盐酸反应时无气体产生),请回答问题并计算。
加入稀盐酸的质量/g | 20.0 | 40.0 | 60.0 | 80.0 | 100 |
生成CO2的质量/g | 0 | 2.2 | 4.4 | m | 5.5 |
(1)氢氧化钙变质是它与空气中的____________发生了反应。
(2)表中m的数值为_____________。
(3)试计算样品中碳酸钙的质量分数___________(请在答题卡上写出计算过程,计算结果精确到0.1%)。
(4)请在坐标中画出加入稀盐酸的质量与生成CO2的质量之间的变化关系图___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】汽车尾气的排放也会带来一系列环境问题。“尾气催化转化器”可将汽车尾气中的有毒气体转化为无毒气体。其反应的微观示意图如下:
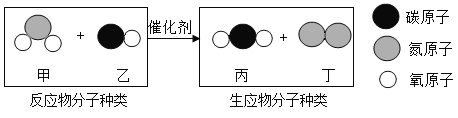
对上述反应认识不正确的是( )。
A.物质丁的化学式为N2
B.参加反应的甲与生成丁的分子个数比为2:1
C.反应后所得气体不再对环境有任何影响
D.若生成56g丁,则参加反应的甲的质量为184g
查看答案和解析>>
科目: 来源: 题型:
【题目】地壳中元素含量由高到低依次是氧、硅、铝、铁等。如图是硅元素在元素周期表中的信息和铝元素的原子结构示意图。下列说法正确的是
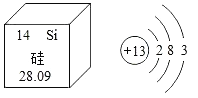
A.硅原子的相对原子质量为28.09g
B.硅元素位于元素周期表的第二周期
C.铝原子易失去最外层的3个电子,形成Al3+
D.由地壳中含量最多的非金属元素和金属元素组成的物质是SiO2
查看答案和解析>>
科目: 来源: 题型:
【题目】氢气是密度最小的无色气体,被认为是最清洁的燃料。
(1)氢气燃烧的化学方程式为_________________,氢能源没有大量使用是因为_________________(写一条即可)。
(2)氢气能夺取金属氧化物中的氧,使其还原为金属,如![]() ,该实验可观察到的固体颜色由_________________。王峰同学根据氢气的还原性,在实验室用如图所示装置测定某赤铁矿中铁元素的质量分数,该赤铁矿中的主要成分是Fe2O3,还含有少量的FeO。C装置的硬质玻璃管中的固体物质是干燥的赤铁矿粉,旋钮a可以控制氢气的_________________。
,该实验可观察到的固体颜色由_________________。王峰同学根据氢气的还原性,在实验室用如图所示装置测定某赤铁矿中铁元素的质量分数,该赤铁矿中的主要成分是Fe2O3,还含有少量的FeO。C装置的硬质玻璃管中的固体物质是干燥的赤铁矿粉,旋钮a可以控制氢气的_________________。
(3)装置A中发生的化学反应方程式为_________________。
(4)装置B中试剂为_________________。
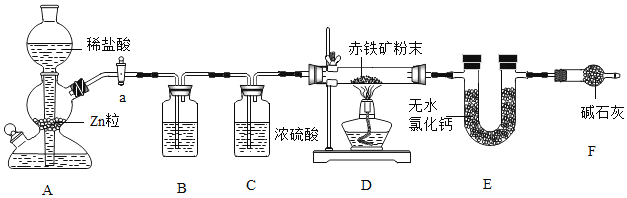
(5)若赤铁矿粉的质量为25 g,完全反应后,U型管E的质量增加了8.1 g。赤铁矿粉中铁元素的质量分数为_________________。
(6)反思与评价:U型管E右边连接干燥管F的目的是_________________,无干燥管F,则测得样品中铁的质量分数会_________________(填“偏小”“不变”或“偏大”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com