
科目: 来源: 题型:
【题目】氢气是一种理想的新能源,具有广阔的开发前景。铁酸锌(ZnFe2O4)可用于循环分解水制氢气,其反应可表示为:
![]() ;
;![]()
(1) ZnFe2O4中Fe的化合价为___________。
(2)该循环制氢中不断消耗的物质是___________。
(3)氢气作为新能源,有不污染环境、热值大、原料来源丰富等优点,但目前并没有被广泛应用,你认为主要原因是_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】燃料的使用为我们的生活提供了方便,工人师傅使用氧炔焰进行金属切割或金属焊接,氧炔焰是乙炔(C2H2)跟氧气发生燃烧反应产生的火焰,回答下列问题:
(1)乙炔属于___________(填“有机物”或“无机物”) 。
(2)已知乙炔完全燃烧时生成二氧化碳和水,请写出其燃烧的化学方程式___________。
(3)实验室用电石(CaC2)与水反应制取乙炔,电石与水的反应比较剧烈,为了得到平稳的乙炔气流,实验时常用饱和食盐水代替水,并用___________(填仪器名称)控制滴加速率,使用__________(填“块状”或“粉末状”)电石固体。
查看答案和解析>>
科目: 来源: 题型:
【题目】溶解度是我们初中化学常见的概念,请回答下列问题。
I.下表是NaC1、KNO3在不同温度下的溶解度:
温度/℃ | 0 | 20 | 40 | 60 | 80 | |
溶解度/g | NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 |
KNO3 | 13.3 | 31.6 | 63.9 | 110 | 169 | |
(1)要比较NaC1、KNO3在水中的溶解能力,需要控制的变量是水的质量和_____________________。
(2)从KNO3溶液中获取其晶体适宜的方法是_____________________。
(3)20℃时,各取NaC1、KNO3固体3.5g加入10g水中,充分溶解后达到饱和状态的是___溶液。
(4)若将上述数据在坐标中绘制成NaCl、KNO3的溶解度曲线,两条曲线的交,点对应的温度范围是(_____)
A 0°C~20°C
B 20°C ~40°C
C 40°C ~60°C
D 60°C ~80°C
II.将质量为30g的B物质加入到50g水中,充分搅拌后,剩余物质的质量随温度的关系如图所示,过程中不考虑水分蒸发,回答问题:
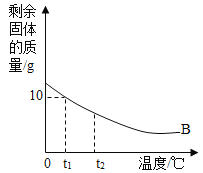
(5)固体B的溶解度随温度的升高而____________(填“增大”或“减小”) 。
(6) t1℃时,B的溶解度是___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】金属及金属材料有很多优良的性能而被广泛应用。
(1)铁制炊具加热食物,说明铁具有的性质是_____________________。
(2)铝制品比铁制品耐用,其原因是____________________。
(3)钛合金因为优良的性能,被广泛应用于生物医学、航空航天等领域,钛合金的优点有________________(任写一条),构成金属钛的粒子是________________(填“分子”“原子”或“离子”) 。
(4)合金Mg2Cu是一种潜在的贮氢材料,高温时在氩气保护下,由一定质量比的Mg、Cu单质熔炼获得。
①熔炼制备Mg2Cu合金时,通入氩气的目的是____________________。
②将11.2g 的Mg2Cu合金与过量盐酸反应,生成氢气的质量为___g。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列四个图象,分别对应四种操作过程,其中正确的是( )
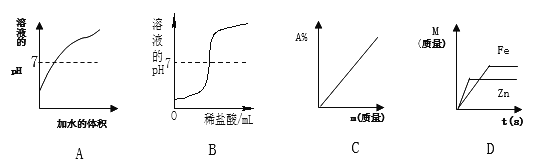
A. 向pH=2的酸溶液中不断加水
B. 向NaOH溶液中逐滴加入稀盐酸
C. 向一定量的水中持续加入食盐(m表示食盐的质量,A%表示溶质质量分数)
D. 等质量的锌、铁与足量的稀硫酸反应,产生氢气的质量随反应时间t的变化
查看答案和解析>>
科目: 来源: 题型:
【题目】如图为某化学反应的微观示意图,其中不同的球代表不同的原子。下列说法正确的是( )
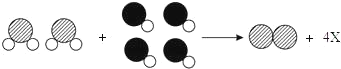
A.该反应属于置换反应
B.1个X分子中有4个原子
C.两种反应物均属于化合物
D.反应前后元素化合价均不改变
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室有一瓶标签模糊的烧碱溶液,小杰设计实验测定了其溶质质量分数。请根据下图所示的实验过程和提供的数据进行分析和计算。(注:滴入酚酞试液的质量忽略不计)

(1)将稀盐酸逐滴滴入锥形瓶的过程中,应边滴加边摇动锥形瓶,当观察到溶液颜色恰好_______________时, 停止滴液。反应所消耗稀盐酸的质量为__________________________g。
(2)通过计算确定该瓶烧碱溶液的溶质质量分数。______(写出计算步骤)
查看答案和解析>>
科目: 来源: 题型:
【题目】为验证“加热碳酸氢铵”所发生的变化和产物,两同学分别用甲、乙所示装置进行实验。
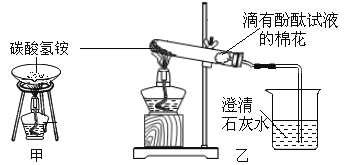
(1)甲实验中的现象是_______________。
(2)乙实验中试管口略向下倾斜的原因是_______________。乙实验中烧杯内反应化学方程式为_______________;实验中棉花逐渐变红色,则可说明反应产物中有_______________;相对于甲实验来说,乙实验的优点有(写一条)_______________。
(二)将一定量的K2CO3溶液与BaCl2溶液混合,过滤反应后的混合物。某兴趣小组的同学们欲探究滤液中溶质的组成。请你一同参与探究并回答有关问题:
[查阅资料]K2CO3溶液显碱性; BaCl2、 KCl溶液显中性。
[提出猜想]猜想1:滤液溶质是KCl;
猜想2:滤液溶质是_______________。
猜想3:滤液溶质是KCl和K2CO3。
[实验探究]
实验操作 | 实验现象 | 实验结论 |
① 取少量滤液于试管中,滴几滴无色酚酞试液,振荡 | 无明显现象 | ①猜想_________不成立 |
② 另取少量滤液于另一支试管中,滴加K2CO3溶液 | ______________ | ②猜想2成立。 写出相关的化学方程式 _____________ |
[问题讨论]小丽同学认为要证明猜想2成立也可改用AgNO3溶液,你认为小丽同学不能达到实验目的,你的理由是_______________。
[反思拓展]实验结束后,组内同学认为K2CO3是盐而其水溶液却显碱性,这可能与它的构成微粒有关,微粒符号是_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com