
科目: 来源: 题型:
| 实验步骤 | 观察到的现象 |
| ①在试管中取少量盐酸,插入铁丝,充分作用. | |
| ②在①所得的溶液中,插入,充分作用. | 无明显现象 |
| ③在②所得的溶液中插入,充分作用. |
查看答案和解析>>
科目: 来源: 题型:


 (3)若要得到干燥的CO2,图(一)还需要一个干燥装置,干燥剂为浓硫酸.图(二)画出了该干燥装置的一部分,请你补充画出其它部分,并用箭头标明气体进出方向.
(3)若要得到干燥的CO2,图(一)还需要一个干燥装置,干燥剂为浓硫酸.图(二)画出了该干燥装置的一部分,请你补充画出其它部分,并用箭头标明气体进出方向.查看答案和解析>>
科目: 来源: 题型:
(2009?德城区)下列除杂质的方法不正确的是( )
|
查看答案和解析>>
科目: 来源: 题型:阅读理解
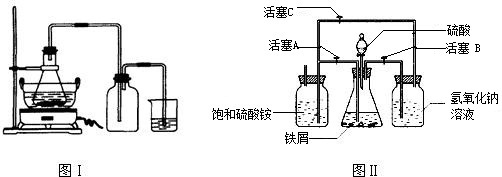
| 序号 | 反应物用量(n表示微粒个数) | 产品质量 |
| 1 | n(H2SO4):n(Fe)>1:1 | 介于1级~Ⅱ级之间 |
| 2 | n(H2SO4):n(Fe)<1:1 | 优于1级 |
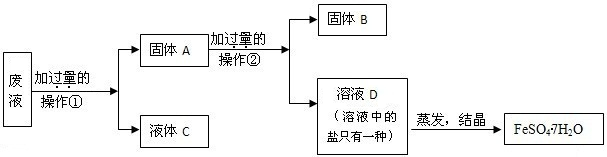
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com