
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 猜想 | 实验步骤 | 现象 | 结论 |
| 猜想① | 将上述红色溶液分成两份,在一份中加少量的植物油. | 没加植物油的红色褪去,另一红色没褪去 |
若猜想①成立 |
| 猜想② | 将上述红色溶液分成两份,并用植物油封住, 一支温度保持不变,另一支自然冷却 . |
前者红色没褪去,后者红色褪去 |
猜想②成立 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 实验步骤 | 实验现象 | 实验结论 |
| ①取适量NaOH固体放入烧杯中,加入适量的水, 用温度计测出溶液的温度(或用手触摸烧杯外壁) |
溶液温度升高(或烧杯壁发烫) |
NaOH固体溶于水时有热量放出 |
| ②待步骤①所得的溶液冷却后,用烧杯取出少量,在其中插入温度计,再用胶头滴管将稀盐酸滴入到烧杯中的溶液里,并用玻璃棒不断搅拌 | 溶液温度升高 |
氢氧化钠与稀盐酸反应会放出热量 |
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
| Cl- | NO3- | CO32- | SO42- | |
| Ba2+ | 溶 | 溶 | 难溶 | 难溶 |
查看答案和解析>>
科目: 来源: 题型:
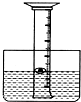 22、为了研究空气中所含氧气的体积,某同学设计如下实验方案:用一个50ml量筒倒扣在水中,量筒内外液
22、为了研究空气中所含氧气的体积,某同学设计如下实验方案:用一个50ml量筒倒扣在水中,量筒内外液查看答案和解析>>
科目: 来源: 题型:
 21、A、B、C、D、E、F是初中化学常见的六种物质,
21、A、B、C、D、E、F是初中化学常见的六种物质,查看答案和解析>>
科目: 来源: 题型:
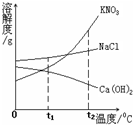 20、右图是KNO3、NaCl、Ca(OH)2三种物质的溶解度曲线图.请回答下列问题:
20、右图是KNO3、NaCl、Ca(OH)2三种物质的溶解度曲线图.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com