
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
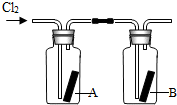 1774年,瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色的气体,有强烈的刺鼻气味.1810年,英国化学家戴维确定这种气体为氯气(Cl2).氯气有剧毒,密度比空气大,约为空气密度的2.5倍,能溶于水,氯气的化学性质活泼,能与水、金属、碱等发生化学反应,氯气与氢氧化钠溶液反应生成氯化钠和次氯酸钠(NaClO).
1774年,瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色的气体,有强烈的刺鼻气味.1810年,英国化学家戴维确定这种气体为氯气(Cl2).氯气有剧毒,密度比空气大,约为空气密度的2.5倍,能溶于水,氯气的化学性质活泼,能与水、金属、碱等发生化学反应,氯气与氢氧化钠溶液反应生成氯化钠和次氯酸钠(NaClO).
| ||
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com