28、物质之间发生化学反应时,常伴随有明显的现象,但有些化学反应却观察不到明显的现象.某班同学为证明NaOH能与稀盐酸发生中和反应,从不同角度设计了如下实验方案,并进行实验.
【方案一】:先在NaOH稀溶液中滴加几滴酚酞试液,溶液显
红
色,然后再滴加盐酸,当观察到
红色褪去
,证明NaOH溶液与稀盐酸发生了化学反应.当得到无色溶液时,小虎认为这时酸与碱恰好完全反应.小英却认为这时还应该存在的另一种情况是
盐酸过量
.接着老师又提出问题:红色消失一定证明是酸与碱发生中和反应吗?他们经过讨论认为也可能是酚酞与酸反应而褪色.这时应在溶液中再滴加
酚酞(或氢氧化钠溶液)
溶液,若有
不变红(或变红)
现象,则证明不是酚酞与酸反应而褪色.
【方案二】:用pH试纸测定NaOH溶液的pH,再滴加盐酸,并不断振荡溶液,同时测定混合溶液的pH,如果测得的pH逐渐变小且小于7,则证明NaOH溶液与稀盐酸发生了化学反应.这时小虎又提出疑问:pH逐渐变小,可能是由于溶液稀释造成的,不能说明一定发生了反应.小全对小虎的疑问进行了反驳,他的理由是:
碱溶液无论如何稀释,其pH值都不可能小于7
.
测定溶液的pH时,需在白瓷板或玻璃片上放一小片pH试纸,用
滴管或玻璃棒
把待测液滴在pH试纸上,过一会儿,将试纸的颜色与
标准比色卡
比较,从而得出溶液的pH.若对一未知溶液用湿润的pH试纸来测定溶液的pH,则测定的结果会
D
.
A.偏大,B.偏小,C.不变,D.以上三种可能都有
【方案三】:在试管中放入一粒NaOH固体,然后加入稀盐酸.
小华看到氢氧化钠固体消失了,认为发生了反应.而小全想了想之后却不同意小华的观点,小全的理由是:
可能是氢氧化钠溶于水
.小明用手摸了摸试管外壁,试管比较热,他认为不仅说明它们发生了反应,而且是放热反应.小全思考之后仍然不同意小明的观点,小全的理由是:
氢氧化钠溶于水也放热
.
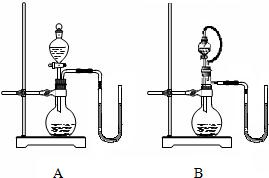
乙同学和丙同学各设计了一个装置(见右图),都说在不使用温度计的情况下可以判断NaOH溶液与稀盐酸发生了中和反应.分析说明:
B
(填序号)装置更合理,理由是
B装置能排除因液体的滴入而造成烧瓶内气体排出,引起玻璃管内液面发生变化
.若选用合理的装置进行实验,当出现
玻璃管中左侧液面下降,右侧液面上升
现象时,可以说明NaOH溶液与稀盐酸发生了反应.
【方案四】:可以通过测定反应前的物质不存在来判断反应的发生.将一定量的稀盐酸溶液平均分为两份,一份直接加入锌粒中,观察到的现象是
有气泡产生
;向另一份中先加入过量的NaOH溶液,再加入锌粒中,观察到
无气泡产生
现象,说明NaOH溶液和HCl溶液发生了反应.锌粒与稀盐酸反应的化学方程式为
Zn+2HCl═ZnCl2+H2↑
.
【方案五】:定量研究是化学研究中的一种重要的方法.一同学将200 mL稀盐酸平均分成两份,其中一份直接加入到w g的CaCO
3中,充分反应后收集到V
1体积的CO
2;向另一份中先滴加一定量的NaOH溶液,充分反应后,也加入到w g的CaCO
3中,反应后收集到V
2体积的CO
2.如果V
1>
V
2(填“>”或“<”或“=”)也能说明NaOH溶液和HCl溶液发生了反应.

 12、食盐和味精是厨房里常用的两种调味品,这两种物质都可溶于水,在相同条件下,哪种物质的溶解能力更强呢?小明进行了以下实验探究:
12、食盐和味精是厨房里常用的两种调味品,这两种物质都可溶于水,在相同条件下,哪种物质的溶解能力更强呢?小明进行了以下实验探究: 28、物质之间发生化学反应时,常伴随有明显的现象,但有些化学反应却观察不到明显的现象.某班同学为证明NaOH能与稀盐酸发生中和反应,从不同角度设计了如下实验方案,并进行实验.
28、物质之间发生化学反应时,常伴随有明显的现象,但有些化学反应却观察不到明显的现象.某班同学为证明NaOH能与稀盐酸发生中和反应,从不同角度设计了如下实验方案,并进行实验.