(2013?昆山市一模)硫酸是基础化学工业的重要产品和原料,也是我们实验室常用常备的化学试剂.工业生产硫酸的主要流程为:
①煅烧黄铁矿(主要反应为:4X+11O
22Fe
2O
3+8SO
2)
②SO
2转化为SO
3③用浓H
2SO
4吸收SO
3.请回答下列问题:
(1)流程①主要反应中X的化学式是
FeS2
FeS2
.
(2)流程①中形成的炉渣可再利用的方法是
将炉渣用来炼铁
将炉渣用来炼铁
.
(3)生产中会有部分SO
2随尾气排入大气中,这会造成对环境的污染.SO
2是一种酸性氧化物,具有与CO
2相似的化学性质,有人设计用消石灰吸收尾气中的SO
2,请写出该反应的化学方程式
SO2+Ca(OH)2═CaSO3+H20
SO2+Ca(OH)2═CaSO3+H20
.
(4)工业生产得到的是浓硫酸,若要将它稀释成稀硫酸,则正确的操作方法是:
将浓硫酸沿着玻璃棒或器壁慢慢倒入水中,并用玻璃棒不断搅拌
将浓硫酸沿着玻璃棒或器壁慢慢倒入水中,并用玻璃棒不断搅拌
.
(5)SO
3溶于水生成硫酸,查阅资料可知H
2SO
4的酸性强于H
2CO
3,请设计一个较简单的实验来证明硫酸的酸性强于碳酸(简要说出实验方法、现象):
向碳酸钠(或碳酸氢钠)中滴加稀硫酸,有气体产生,说明硫酸的酸性强于碳酸;(或取硫酸和碳酸两溶液,分别加入碳酸钠或碳酸氢钠,稀硫酸中有气泡产生,碳酸溶液中无明显现象,说明硫酸的酸性强于碳酸)
向碳酸钠(或碳酸氢钠)中滴加稀硫酸,有气体产生,说明硫酸的酸性强于碳酸;(或取硫酸和碳酸两溶液,分别加入碳酸钠或碳酸氢钠,稀硫酸中有气泡产生,碳酸溶液中无明显现象,说明硫酸的酸性强于碳酸)
.

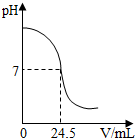 (2013?昆山市一模)利用中和反应可以测定酸或碱溶液中溶质的质量分数.如图为某次测定过程中溶液的pH随所滴加的某标准溶液体积变化而变化的关系图.
(2013?昆山市一模)利用中和反应可以测定酸或碱溶液中溶质的质量分数.如图为某次测定过程中溶液的pH随所滴加的某标准溶液体积变化而变化的关系图.