
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
|
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 点燃 |
| 点燃 |
查看答案和解析>>
科目: 来源: 题型:
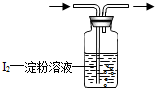 (2012?苏州)为判断某物质存在或某物质恰好完全反应,通常以特定物质的显色达到目,能显色的物质就称“指示剂”.如:用蓝色的石蕊试纸变红判断待测液显酸性;用淀粉溶液变蓝判断单质碘(I2)的存在:
(2012?苏州)为判断某物质存在或某物质恰好完全反应,通常以特定物质的显色达到目,能显色的物质就称“指示剂”.如:用蓝色的石蕊试纸变红判断待测液显酸性;用淀粉溶液变蓝判断单质碘(I2)的存在:查看答案和解析>>
科目: 来源: 题型:
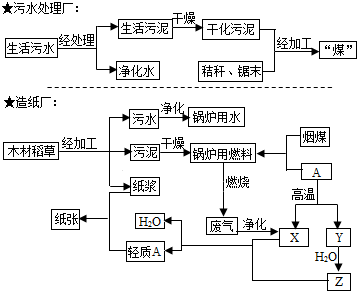
| ||
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com