
科目: 来源: 题型:
 (2013?东港市二模)实验小组对铁的锈蚀按下表探究.室温时,将包有样品的滤纸包固定在橡胶塞上,迅速塞紧,装置如下图.观察到量筒内水沿导管慢慢进入广口瓶(净容积为146mL).当温度恢复至室温,且量筒内水面高度不变时读数(此时瓶内氧气含量近似为零).记录起始和最终量筒的读数以及所需时间如下表.
(2013?东港市二模)实验小组对铁的锈蚀按下表探究.室温时,将包有样品的滤纸包固定在橡胶塞上,迅速塞紧,装置如下图.观察到量筒内水沿导管慢慢进入广口瓶(净容积为146mL).当温度恢复至室温,且量筒内水面高度不变时读数(此时瓶内氧气含量近似为零).记录起始和最终量筒的读数以及所需时间如下表.| 序号 | 样品 | 量筒起始读数 /mL |
量筒最终读数 /mL |
所需时间 /min |
| ① | 1g铁粉、0.2g碳和10滴水 | 100 | 70 | 约120 |
| ② | l g铁粉、0.2g碳、10滴水和少量NaCl | 100 | 70 | 约70 |
| ③ |
查看答案和解析>>
科目: 来源: 题型:
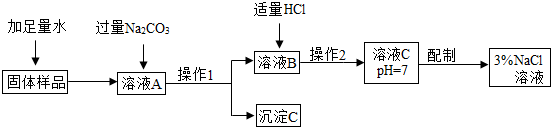

查看答案和解析>>
科目: 来源: 题型:
| 金属单质 | 铜 | 铝 | 锌 | 铁 | 铅 |
| 导电性(以银的导电性为100作标准) | 99 | 61 | 27 | 17 | 7.9 |
| 密度/(g?cm-3) | 8.92 | 2.70 | 7.14 | 7.86 | 11.3 |
| 熔点/℃ | 1083 | 660 | 419 | 1535 | 328 |
| 硬度(以金刚石的硬度为10作标准) | 2.5~3 | 2~2.9 | 2.5 | 4~5 | 1.5 |
| ||
| ||
| ||
| ||

查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
 (2013?番禺区一模)如图是KNO3和NaCl的溶解度曲线.据图回答:
(2013?番禺区一模)如图是KNO3和NaCl的溶解度曲线.据图回答:| 烧杯编号 | NaCl/g | H2O/g | 溶质的质量分数 |
| 1 | 10 | 90 | |
| 2 | 30 | 70 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com