
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 稀硫酸 | 澄清石灰水 | 镁与稀硫酸恰好反应后溶液 | 稀盐酸 | |
| 溶质 | H2SO4 H2SO4 |
Ca(OH)2 Ca(OH)2 |
MgSO4 MgSO4 |
HCl HCl |
| 溶剂 | H2O H2O |
H2O H2O |
H2O H2O |
H2O H2O |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
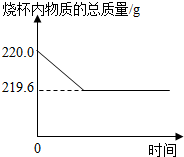 体溶解忽略不计).
体溶解忽略不计).查看答案和解析>>
科目: 来源: 题型:
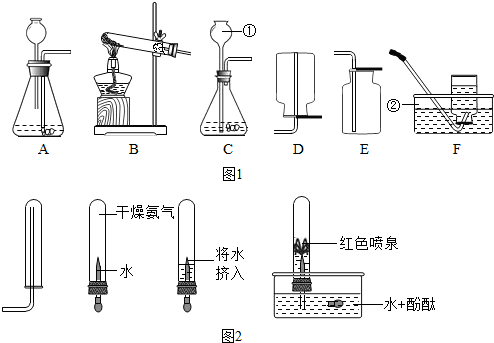
| ||
| ||
查看答案和解析>>
科目: 来源: 题型:
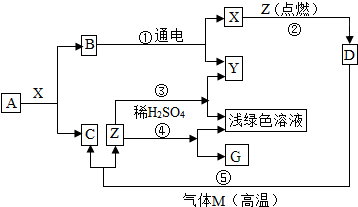
| ||
| ||
查看答案和解析>>
科目: 来源: 题型:
| 实验目的 | 编号 | 温度 | 镁的形态 | 硫酸浓度 |
| 1、①和②硫酸浓度对该反应速率影响 2、①和③温度对该反应速率影响; 3、②和④镁与酸的接触面积对该反应速率影响 |
① | 镁片 | ||
| ② | 25?C | 5% | ||
| ③ | 镁片 | |||
| ④ | 25?C | 5% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com