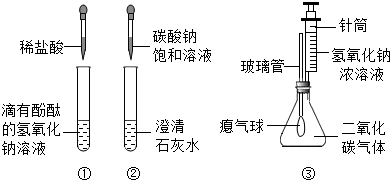
某兴趣小组在学习碱的化学性质时,进行了如下所示的实验.
(1)实验①中盐酸和氢氧化钠反应的化学方程式为
NaOH+HCl=NaCl+H2O
NaOH+HCl=NaCl+H2O
.
(2)实验②中观察到试管内有白色沉淀产生,反应的化学方程式为
Na2CO3+Ca(OH)2=2NaOH+CaCO3↓
Na2CO3+Ca(OH)2=2NaOH+CaCO3↓
.
(3)实验③中滴加氢氧化钠溶液后,可观察到的现象是
气球胀大
气球胀大
.
实验结论:碱能与多种类别的物质发生反应,包括指示剂、非金属氧化物、酸和盐类等.
【反思交流】实验结束后,同学们对实验②的废液成分进行了探究:将实验②的废液进行过滤,滤渣所含的成分是
碳酸钙
碳酸钙
.
【提出问题】滤液中所含溶质是什么物质呢?
【做出猜想】猜想一:滤液中的溶质是氢氧化钠.
猜想二:滤液中的溶质是氢氧化钠和碳酸钠.
猜想三:滤液中的溶质是氢氧化钠和
氢氧化钙
氢氧化钙
.
【实验设计】同学们取滤液样品并加入酚酞溶液,溶液呈红色,继续逐滴加入稀盐酸,发现溶液逐渐变无色,同时有气泡产生.由此得出结论,猜想
二
二
正确.

