在一次实验室分组实验中,李武同学不小心把硫酸铜溶液(CuSO
4固体溶于水形成的混合物)滴加到盛有5%H
2O
2溶液的试管中,立即产生大量的气泡.硫酸铜溶液中含有三种微粒( H
2O、Cu
2+、SO
42- ),他想知道硫酸铜溶液中的哪一种微粒能使双氧水分解的速率加快.他和同学一起通过以下实验完成这次探究活动,并填写空白.
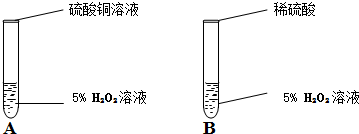
(1)你认为最不可能的是哪一种微粒?
H2O(或水分子)
H2O(或水分子)
.理由是
双氧水溶液中含有水分子
双氧水溶液中含有水分子
.
(2)用化学式表示实验A发生的化学反应
,检验该反应产生气体的方法是
用带火星的木条伸入到试管A中,木条复燃,证明是氧气
用带火星的木条伸入到试管A中,木条复燃,证明是氧气
.
(3)在实验B中加入稀硫酸(含有H
2O、H
+、SO
42-)后,无明显变化,证明
SO42-(或硫酸根离子)
SO42-(或硫酸根离子)
不起催化作用.
结论:硫酸铜溶液中,加快双氧水分解速率的微粒是
Cu2+(或铜离子)
Cu2+(或铜离子)
.
(4)要验证双氧水分解速率与双氧水的浓度有关,可以进行以下实验:取两套相同装置,其中一套加入5%的双氧水溶液和MnO
2,你认为另一套装置所加药品应该是
a
a
和
b
b
(填序号).
a.15%的双氧水溶液 b.MnO
2 c.5%的双氧水溶液 d.硫酸铜溶液
(5)小东同学注意到试管内只有15%的双氧水时就有少量小气泡浮起,将这支试管浸入约80°C的热水中,气泡明显增多,由此小东认为,双氧水分解速率还与
温度
温度
有关.


