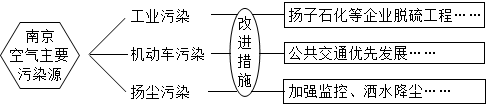
(2013?雨花台区一模)某班化学实验课进行酸碱盐的性质实验.
【自制酸碱指示剂】
(1)取少量紫包菜和白菜叶剪碎后分别放在研钵中捣烂,加入酒精浸泡;用纱布将浸泡出的汁液挤出,分别装好待用.
(2)取四支试管分别用NaOH溶液和稀盐酸进行实验,观察到现象如图,记录如下:

|
NaOH溶液 |
稀盐酸 |
苹果汁 |
| 紫包菜汁液 |
①绿色 |
②红色 |
红色 |
| 白菜汁液 |
③无色 |
④淡黄色 |
淡黄色 |
你认为两种汁液中,更适合做酸碱指示剂的是
紫包菜汁液
紫包菜汁液
.
(3)再用苹果汁进行相同实验,现象记录见上表.则苹果汁溶液显
酸
酸
性.
【酸碱盐的性质】
第一组学生进行CuSO
4与NaOH溶液的反应,观察到的现象是
有蓝色沉淀
有蓝色沉淀
;
第二组学生进行BaCl
2与Na
2CO
3溶液的反应,反应的方程式为
BaCl2+Na2CO3═BaCO3↓+2NaCl
BaCl2+Na2CO3═BaCO3↓+2NaCl
.
从复分解反应发生的微观本质上看,中和反应的实质可以用下图1表示,那么请在图2虚框中将CuSO
4与NaOH溶液的反应的微观示意图补充完整.
【废液再探究】
实验结束后,两组同学将全部的浊液集中倒进一个废液缸中.化学兴趣小组对浊液进行过滤,得到无色滤液,进一步探究无色滤液的成分.
【提出问题】滤液里溶质除了NaCl外,还有什么物质?
【提出猜想】猜想①:BaCl
2; 猜想②:Na
2SO
4; 猜想③:NaOH;猜想④:BaCl
2、NaOH 猜想:⑤Na
2CO
3、Na
2SO
4 猜想:⑥Na
2SO
4、NaOH 猜想:⑦Na
2CO
3、Na
2SO
4和
NaOH
NaOH
【实验探究】
(1)取样,滴加紫包菜叶汁,显绿色,小军判断一定含NaOH,小华不同意,理由是
Na2CO3溶液也呈现碱性
Na2CO3溶液也呈现碱性
.
(2)取样,加入足量的稀硫酸,无明显现象,则猜想
①④⑤⑦
①④⑤⑦
一定不成立.
(3)为确定该滤液的组成,还需补充的实验是:
取样,加足量的BaCl2 溶液
取样,加足量的BaCl2 溶液
,若观察到白色沉淀,则该无色滤液的组成有
Na2SO4、NaOH NaCl
Na2SO4、NaOH NaCl
.


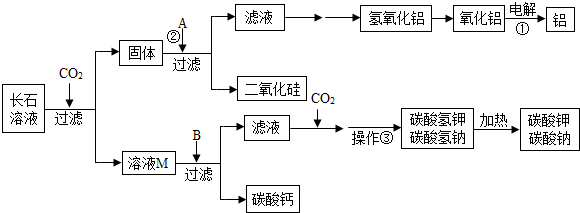
 (2013?雨花台区一模)A~H是初中化学常见的物质.已知A、C常温下为气体,且组成元素相同;B为铁锈的主要成分,F为黑色粉末,它们的转化关系如图所示.请回答:
(2013?雨花台区一模)A~H是初中化学常见的物质.已知A、C常温下为气体,且组成元素相同;B为铁锈的主要成分,F为黑色粉末,它们的转化关系如图所示.请回答: (2013?雨花台区一模)实验室欲用已配好的质量分数为10%的氢氧化钠溶液(密度为1.1g/cm3),配制100g质量分数为5%的氢氧化钠溶液,并用此溶液测定某硫酸溶液的溶质质量分数.
(2013?雨花台区一模)实验室欲用已配好的质量分数为10%的氢氧化钠溶液(密度为1.1g/cm3),配制100g质量分数为5%的氢氧化钠溶液,并用此溶液测定某硫酸溶液的溶质质量分数.