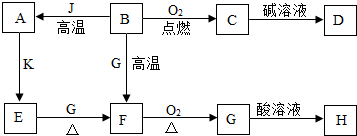
某校化学兴趣小组参观制碱厂后,获得以下信息并对相关问题进行研究.
【产品与原理】该厂采用“侯氏制碱法”生产化工产品--纯碱和化肥NH
4Cl.
生产原理是:将NH
3和CO
2通入饱和食盐水中得到NaHCO
3和NH
4Cl的混合物,反应为:NaCl(饱和)+NH
3+CO
2+H
2O=NaHCO
3↓+NH
4Cl;分离出NaHCO
3,加热制得纯碱.
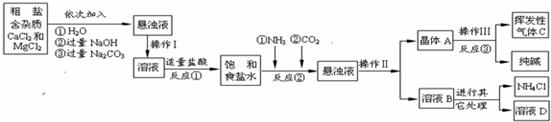
【生产流程】
【相关资料】(1)NH
4Cl═NH
3↑+HCl↑
(2)已知20℃时有关物质的溶解度如下(气体指1体积水中能溶解的气体体积)
| 物质 |
NaCl |
NaHCO3 |
NH4Cl |
NH3 |
CO2 |
| 溶解度 |
36.0g |
9.6g |
37.2g |
710g |
0.9g |
【问题讨论】
(1)操作Ⅰ、Ⅱ、Ⅲ中,相同操作的名称为
过滤
过滤
.
(2)反应①中发生了两个反应,写出其中的一个化学方程式:
NaOH+HCl═NaCl+H2O或Na2CO3+2HCl═2NaCl+H2O+CO2↑;
NaOH+HCl═NaCl+H2O或Na2CO3+2HCl═2NaCl+H2O+CO2↑;
.
(3)溶液B中的溶质有
NaHCO3、NaCl、NH4Cl、NH4HCO3四种任选两种
NaHCO3、NaCl、NH4Cl、NH4HCO3四种任选两种
(至少写出两种).
(4)上述生产流程中可循环使用的是
AB
AB
(填序号).
A.挥发性气体C B.溶液D C.氢氧化镁 D.化肥NH
4Cl
【含量测定】
| 工业纯碱标准:(Na2CO3%≥) |
| 优等品 |
一等品 |
合格品 |
| 99.2 |
98.8 |
98.0 |
称取纯碱样品10.8g加入适量水,再加入过量CaCl
2溶液,搅拌、过滤、洗涤、干燥后称得固体质量为10.0g,请通过计算并结合右表判断此纯碱样品等级为
合格
合格
品.
计算过程:
98.1%
98.1%
(计算结果保留一位小数)
【总结反思】某同学认为,在上述纯碱含量测定中,将CaCl
2溶液改为BaCl
2溶液,测定误差会减小,其理由是
等质量的碳酸钠与氯化钡反应产生的碳酸钡沉淀质量大,所以称量时的(相对)误差较小.
等质量的碳酸钠与氯化钡反应产生的碳酸钡沉淀质量大,所以称量时的(相对)误差较小.
.