
科目: 来源: 题型:阅读理解
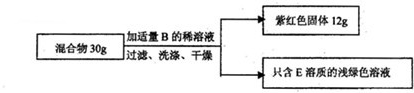
| 12g | 30g |
查看答案和解析>>
科目: 来源: 题型:

| ||
| △ |
| ||
| △ |
查看答案和解析>>
科目: 来源: 题型:阅读理解
 据JEA(国际能源机构)的国际能源消费报告:就是街上的大多数人(大约43%的世界人口)主要使用的能源是石油,天然气紧随其后,其占有率为15%;可燃的可再生能源以及垃圾占到了13%,煤炭和替代性能源(地热、水电和太阳能)分别占到了8%和3.5%.
据JEA(国际能源机构)的国际能源消费报告:就是街上的大多数人(大约43%的世界人口)主要使用的能源是石油,天然气紧随其后,其占有率为15%;可燃的可再生能源以及垃圾占到了13%,煤炭和替代性能源(地热、水电和太阳能)分别占到了8%和3.5%.查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com