CO
2可用于制备碳酸饮料,人饮后有清凉感.某同学设计如下实验,测定某品牌碳酸饮料中的CO
2的含量.
实验方案一:
①将250mL瓶装碳酸饮料放在冰箱中冷冻至刚好结冰;
②将饮料从冰箱内取出,迅速加入质量分数为50%NaOH溶液5mL;倒转饮料瓶,轻轻震荡,然后放置恢复至室温,待测定;
③称得装置C的质量为x g,按图1连接实验装置.取50mL待测液至仪器②中,关闭开关a,打开仪器①的活塞,向仪器②中注入稀盐酸,至不再产生气泡,关闭仪器①的活塞;
④打开开关a,向装置中鼓入空气,一段时间后,称量C装置质量为y g.
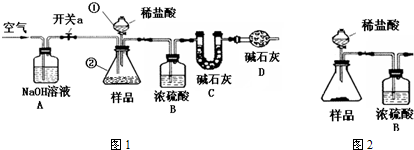
注:实验中各种溶液的密度都视为1g/mL.碱石灰是CaO与NaOH的固体混合物.
(1)上述装置中,仪器①的名称为
分液漏斗
分液漏斗
,仪器②的名称为
锥形瓶
锥形瓶
.
(2)装置A的目的是
吸收空气中的二氧化碳和水
吸收空气中的二氧化碳和水
,装置D的目的是
防止空气中的二氧化碳和水进入,影响实验结果
防止空气中的二氧化碳和水进入,影响实验结果
.
(3)步骤①冷冻碳酸饮料的目的是
防止二氧化碳逸出
防止二氧化碳逸出
.步骤②中反应的化学方程式为
Na2CO3+2HCl═2NaCl+H2O+CO2↑
Na2CO3+2HCl═2NaCl+H2O+CO2↑
,加入NaOH溶液的目的是
吸收二氧化碳
吸收二氧化碳
.
(4)步骤④鼓入空气的目的是
让生成的二氧化碳全部进入装置C中
让生成的二氧化碳全部进入装置C中
.
(5)根据题中提供的数据计算此品牌碳酸饮料中CO
2的含量为
20(y-x)
20(y-x)
g/L.
(6)若没有B装置,则测得CO
2含量会
偏大
偏大
.(填“偏大”或“偏小”)
实验方案二:
①②与方案一相同;③按图2连接实验装置.称得整个装置(含药品)的质量,打开活塞注入足量稀盐酸,间隔10s连续称量整个装置的质量,直到整个装置的质量不变为止.
(1)注入足量稀盐酸后发生的化学反应方程式为
Na2CO3+2HCl═2NaCl+H2O+CO2↑
Na2CO3+2HCl═2NaCl+H2O+CO2↑
.
(2)该实验中称量操作至少进行
3
3
次.
(3)装置B的目的是
吸收气体中的水分
吸收气体中的水分
.
(4)有同学提出该方案测得CO
2含量会偏小,该同学的理由除了可能是空气中水蒸气对实验结果的影响外,还可能是
锥形瓶内残留有二氧化碳
锥形瓶内残留有二氧化碳
.