(2012?镇江)有一工业过程:电石(CaC
2)
灰浆
残渣
其中电石与水的反应为:CaC
2+2H
2O=Ca(OH)
2+C
2H
2↑
(1)残渣中主要成分是Ca(OH)
2和
CaCO3
CaCO3
.
工业上利用乙炔(C
2H
2)产生的灰浆和残渣制备化工原料KClO
3和超细CaCO
3.
Ⅰ.制备KClO
3的流程如下:
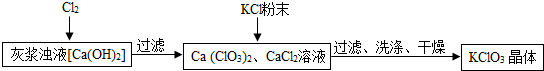
(2)向灰浆浊液中通入Cl
2,得到Ca(ClO
3)
2、CaCl
2溶液.反应中Ca(ClO
3)
2与CaCl
2的化学计量数分别为1和5.写出此反应的化学方程式
6Cl2+6Ca(OH)2=Ca(ClO3)2+5CaCl2+6H2O
6Cl2+6Ca(OH)2=Ca(ClO3)2+5CaCl2+6H2O
.
(3)有关物质在常温下的溶解度如下:
| 物质 |
Ca(ClO3)2 |
CalO3 |
KClO3 |
KCl |
| 溶解度/g |
209.0 |
74.5 |
7.3 |
34.2 |
上述流程中加入KCl粉末,KCl与
Ca(ClO3)2
Ca(ClO3)2
(填化学式)发生了复分解反应,得到KClO
3晶体.你认为能得到KClO
3晶体的原因是
KClO3在常温下溶解度较小
KClO3在常温下溶解度较小
.
(4)洗涤时,可选用下列
B、C
B、C
洗涤剂(填字母编号).
A、KCl饱和溶液 B、冰水 C、饱和KClO
3溶液
Ⅱ.制备超细CaCO
3的流程如下(注:加入NH
4Cl的目的是溶解残渣中的难溶盐):
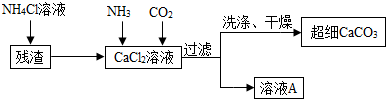
(5)向CaCl
2溶液中通入两种气体,生成超细CaCO
3的化学方程式
CaCl2+2NH3+CO2+H2O=CaCO3↓+2NH4Cl
CaCl2+2NH3+CO2+H2O=CaCO3↓+2NH4Cl
.
(6)流程中溶液A可循环使用,其主要成分的化学式是
NH4Cl
NH4Cl
.

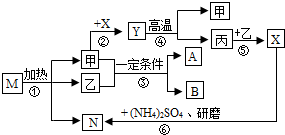 (2012?镇江)甲、乙、丙都属于氧化物,M是一种不含金属元素的盐,反应③是自然界中最为普遍的反应,其中A属于单质.它们的转化关系如图所示.
(2012?镇江)甲、乙、丙都属于氧化物,M是一种不含金属元素的盐,反应③是自然界中最为普遍的反应,其中A属于单质.它们的转化关系如图所示.

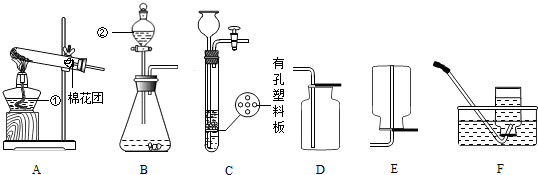
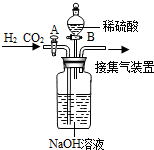 (4)实验室用锌粒和稀硫酸反应制取氢气,常选用装置B或装置C,C与B相比较,其优点是
(4)实验室用锌粒和稀硫酸反应制取氢气,常选用装置B或装置C,C与B相比较,其优点是 (2012?镇江)如图为用乙烯(C2H4)处理NO脱硝的原理.
(2012?镇江)如图为用乙烯(C2H4)处理NO脱硝的原理.
 (2012?镇江)如图是同一座大理石雕像分别在不同年代的照片.
(2012?镇江)如图是同一座大理石雕像分别在不同年代的照片.