(2006?天河区一模)某化学学习小组的同学为了探究氢氧化钠溶液与稀盐酸是否恰好完全反应,做了如下图所示的实验:
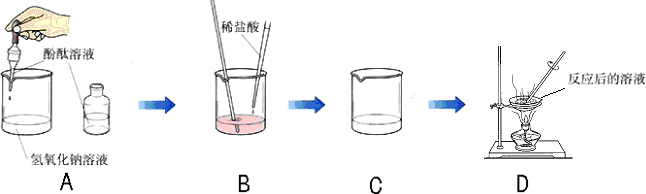
(1)实验中酚酞溶液的作用是
指示氢氧化钠与盐酸何时恰好完全反应;
指示氢氧化钠与盐酸何时恰好完全反应;
.
(2)D中溶液蒸发后留下的固体是(写化学式)
NaCl,
NaCl,
,能说明此结论的实验现象是
B中的溶液由红色变成无色.
B中的溶液由红色变成无色.
.
(3)如果经测定,蒸发得到的固体中含有CaCl
2(其溶液为中性),那么原NaOH溶液(假定盐酸纯净)中可能混有的杂质是(任写一种杂质的化学式)
Ca(OH)2(或CaCl2).
Ca(OH)2(或CaCl2).
.
同学们为了尝试测定上述食盐(含杂质CaCl
2)的质量分数并提纯,做了如下实验.请根据实验回答有关问题:
①准确称取10g固体样品,溶于适量蒸馏水中,再加入过量的下列某溶液,反应后过滤,得沉淀物1g.加入的某溶液是
C
C
(填编号).
A.NaOH B.K
2CO
3 C.Na
2CO
3 D.AgNO
3 E.HCl(稀)
其反应的化学方程式是
CaCl2+Na2CO3═CaCO3↓+2NaCl
CaCl2+Na2CO3═CaCO3↓+2NaCl
②往滤液中加入过量的稀盐酸,加入过量稀盐酸的原因是
将滤液中过量的Na2CO3完全除去,以便蒸发后得到纯净的食盐
将滤液中过量的Na2CO3完全除去,以便蒸发后得到纯净的食盐
.
③将加入稀盐酸后的滤液放在蒸发皿里加热蒸发.加热过程中,要用玻璃棒不断搅拌,其作用是
使液体受热均匀,防止液滴飞溅
使液体受热均匀,防止液滴飞溅
.
④计算样品中NaCl的质量分数为
88.9%
88.9%
.


