请你参与下列探究.
[问题情景]某化学实验小组同学将铁粉投入硫酸铜溶液中,发现生成红色固体物质的同时,有较多的气泡放出.这一现象激发起同学们的探究欲望,生成的是什么气体呢?
[提出猜想]从物质组成元素的角度分析,放出的气体可能是SO
2、O
2、H
2.
[查阅资料]SO
2易溶于水,它能与NaOH溶液反应,生成Na
2SO
3和H
2O.浓硫酸是干燥剂,能吸水.
[方案设计]依据上述猜想,实验小组同学分别设计了如下方案:
(1)甲同学认为是O
2,则检验方法是
用试管收集气体,用带火星的木条放在试管内,看是否复燃
用试管收集气体,用带火星的木条放在试管内,看是否复燃
.
(2)乙同学认为是SO
2,则只需将放出的气体通入盛有NaOH溶液的洗气瓶中,称量通气前后洗气瓶的质量.写出SO
2与NaOH反应的化学方程式:
S02+2NaOH═Na2S03+H2O
S02+2NaOH═Na2S03+H2O
.
(3)实验小组同学合作设计了如图1组合实验方案,排除和验证猜想的气体.
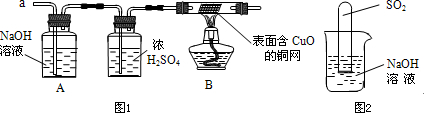
如果放出的是O
2和H
2的混合物,你认为方案中的安全隐患是
可能会发生爆炸
可能会发生爆炸
.
丙同学认为:为确保安全,实验前应先收集一试管气体,用拇指
堵住试管口,移到酒精灯火焰上方,松开拇指
堵住试管口,移到酒精灯火焰上方,松开拇指
,若不发出
尖锐的爆鸣声
尖锐的爆鸣声
,方可采用上面的装置进行实验.
[实验探究]经丙同学确认安全后,小组同学首先对装置A进行称量,再将收集到的气体从a通入,过一会儿点燃B处酒精灯;一段时间后,发现表面含CuO的铜网由黑色变为光亮的红色;停止通气,再次称量装置A,发现质量不变.
结论:(4)铁粉与硫酸铜溶液反应时,产生的气体是
氢气
氢气
.
(5)写出H
2还原CuO的化学方程式:
.
[思维拓展]
(6)不通过称量,如何判断SO
2与NaOH溶液发生了反应呢?有一同学设计了如图2所示的装置进行实验,发现试管内液面上升,就得出SO
2与NaOH溶液发生反应的结论.其他同学认为这一方案不严谨,理由是
二氧化硫能够溶于水,也会造成液面上升
二氧化硫能够溶于水,也会造成液面上升
.

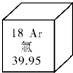 (元素周期表是学习化学的重要工具.如图是元素周期表中的一格,从中可知
(元素周期表是学习化学的重要工具.如图是元素周期表中的一格,从中可知


 为了消除碘缺乏病,我国政府规定居民的食用盐必须是加碘食盐,简称碘盐.所谓碘盐就是在食盐中加入一定量碘酸钾(KIO3).图为“云鹤牌”精制碘盐包装袋上的部分说明文字,请回答下列问题:
为了消除碘缺乏病,我国政府规定居民的食用盐必须是加碘食盐,简称碘盐.所谓碘盐就是在食盐中加入一定量碘酸钾(KIO3).图为“云鹤牌”精制碘盐包装袋上的部分说明文字,请回答下列问题: