阅读资料:
(1)氢氧化钠溶液可以与二氧化碳反应生成碳酸钠和水;
(2)浓硫酸可以吸收水分可作干燥剂,与CO、CO
2均不反应
(3)铁粉为黑色粉末.
为了测定某赤铁矿粉末中氧化铁的质量分数,某兴趣小组设计了图装置进行实验.(假设杂质不反应,每步反应均能完全进行)
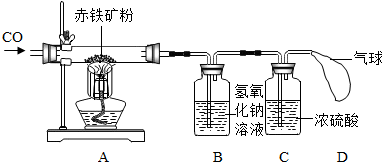
[实验步骤]
①连接装置,并检查气密性,向A装置玻璃管中加入5g红色的赤铁矿粉末;
②将足量氢氧化钠溶液和浓硫酸分别加入B、C装置;
③称量实验前相应装置的质量;
④向A装置中持续缓缓通入纯净CO一会儿,再点燃酒精灯;
⑤充分反应后,熄灭酒精灯,继续通CO至玻璃管冷却后,停止通CO;
⑥称量实验后相应装置的质量和玻璃管中剩余固体质量.
请回答下列问题:
(1)实验时A装置玻璃管中的现象是
红色固体变成黑色
红色固体变成黑色
,反应的化学方程式为
.
(2)B装置的作用是
吸收二氧化碳
吸收二氧化碳
,用气球收集气体的原因是
CO有毒不能排放到空气中
CO有毒不能排放到空气中
.
(3)实验步骤④中,先通入CO一会儿,再点燃酒精灯是为了
排出空气防止爆炸
排出空气防止爆炸
.
(4)可以通过不同的方法计算赤铁矿粉末中Fe
2O
3的质量分数:
方法一:通过获取反应生成的CO
2质量,计算出赤铁矿粉末中Fe
2O
3的质量分数.为获取反应生成的CO
2质量,可以通过比较实验前后
BC
BC
装置(填标号)的质量变化获得.
方法二:通过比较实验前后玻璃管中固体质量变化,计算出赤铁矿粉末中Fe
2O
3的质量分数.若实验后称得玻璃管中固体的质量为3.8g,则赤铁矿粉末中Fe
2O
3的质量分数是
80%
80%
.