
科目: 来源: 题型:
北京市某日的空气质量日报如下表:
|
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
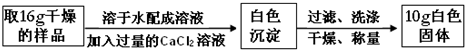
查看答案和解析>>
科目: 来源: 题型:阅读理解
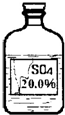 碱式碳酸铜[化学式为Cu2(OH)2CO3,相对分子质量为222]加热完全分解后得到的黑色固体是什么呢?甲、乙、丙三位同学想通过实验探究,来确定该黑色固体的组成.
碱式碳酸铜[化学式为Cu2(OH)2CO3,相对分子质量为222]加热完全分解后得到的黑色固体是什么呢?甲、乙、丙三位同学想通过实验探究,来确定该黑色固体的组成.
| ||
| ||
| 12 |
| 222 |
| 12 |
| 222 |
| 物 质 | H2SO4 | Na2SO4 | MgSO4 |
| 常温下的溶解度∕g | 与水以任意比互溶 | 18.0 | 39.0 |
查看答案和解析>>
科目: 来源: 题型:

| ||
| △ |
| ||
| △ |
查看答案和解析>>
科目: 来源: 题型:阅读理解
| ||

查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
| 物质 每100g含有 |
| 脂肪 11.7g |
| 糖类 55.7g |
| 乳酸亚铁 29.5mg |
| 维生素A 570μg |
| 维生素C 60mg |
查看答案和解析>>
科目: 来源: 题型:
只用下列鉴别方法不能把待鉴别的物质区分开的是( )
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com