(2012?浦东新区二模)在学习酸碱中和反应时,同学们做了稀硫酸和氢氧化钠溶液反应的实验.
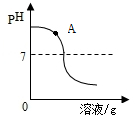
(1)甲组在实验过程中测定了其中一种溶液的pH变化,由图可知,该小组同学测定的是
NaOH
NaOH
溶液的pH变化,该反应的化学方程式为
2NaOH+H2SO4═Na2SO4+2H2O
2NaOH+H2SO4═Na2SO4+2H2O
.实验过程中,同学们取了右图中A点所得溶液,加入试剂
Ⅲ
Ⅲ
(填序号),观察到有蓝色沉淀生成.
Ⅰ.BaCl
2溶液Ⅱ.Fe
2(SO
4)
3溶液Ⅲ.CuSO
4溶液
结论:酸碱没有恰好中和,A点溶液中的溶质为
Na2SO4和NaOH
Na2SO4和NaOH
.
(2)乙组向滴有酚酞的氢氧化钠溶液中滴加稀硫酸,可观察到
红色变为无色
红色变为无色
.
结论:酸碱可能恰好中和,也可能硫酸过量.
为了进一步确定反应后所得溶液中是否含有硫酸,乙组同学设计了如下两种方案:
方案一:取反应后溶液于试管中,滴加碳酸钠溶液,若观察到
冒气泡
冒气泡
,则硫酸过量;
方案二:取反应后溶液于试管中,滴加氢氧化钡溶液,若产生白色沉淀,则硫酸过量.
你认为上述两种方案,哪种不合理?并说明理由
方案二不合理,因为Na2SO4与Ba(OH)2反应也生成白色沉淀
方案二不合理,因为Na2SO4与Ba(OH)2反应也生成白色沉淀
.

 (2012?浦东新区二模)在学习酸碱中和反应时,同学们做了稀硫酸和氢氧化钠溶液反应的实验.
(2012?浦东新区二模)在学习酸碱中和反应时,同学们做了稀硫酸和氢氧化钠溶液反应的实验.
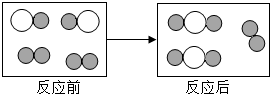 “
“ ”和“
”和“ ”分别表示不同元素的原子:
”分别表示不同元素的原子: ”聚集成的物质
”聚集成的物质 ”与“
”与“ ”的个数比为
”的个数比为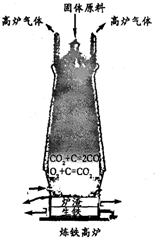 金属是一类重要的材料,人类的日常生产和生活都离不开金属.
金属是一类重要的材料,人类的日常生产和生活都离不开金属.