胆矾(CuSO
4?5H
2O)是重要的化工原料,工业上用Cu与浓H
2SO
4、浓HNO
3反应制备该物质,采取间歇加热、逐渐加入浓HNO
3的方法来制备CuSO
4?5H
2O的新工艺.模拟制备装置如图所示,根据题意回答下列问题.
(1)如图1装置中,分液漏斗内装的液体是
浓硝酸
浓硝酸
(填“浓硝酸”或“浓硫酸”),该发应会产生有毒气体NO、NO
2等,锥形瓶中液体可以吸收该气体,反应原理为:NO+NO
2+2NaOH=2NaNO
2(该物质化学名是
亚硝酸钠
亚硝酸钠
)+H
2O.该装置中搅拌器的作用是
充分接触,加快反应速率
充分接触,加快反应速率
.反应所得产品在
三颈烧瓶
三颈烧瓶
(填“三颈烧瓶”或“锥形瓶”)中.
(2)如果铜粉、硫酸及硝酸都比较纯净,则制得的CuSO
4?5H
2O中常常含有的杂质是一种硝酸盐,其化学式是
Cu(NO3)2
Cu(NO3)2
,已知10℃、20℃时有关物质的溶解度为:CuSO
4?5H
2O(17.4g、20.7g);该硝酸盐(95.3g、125.1g),提纯CuSO
4?5H
2O的实验操作是
重结晶(或冷却结晶)
重结晶(或冷却结晶)
.
(3)用无水硫酸铜检验某双氧水中是否含水时,除了发现固体变蓝外,还发现该双氧水中有气泡产生,对此现象你的猜想是
铜离子作催化剂,双氧水分解出氧气
铜离子作催化剂,双氧水分解出氧气
,检验该气体的实验操作是
用带火星木条检验,看是否复燃
用带火星木条检验,看是否复燃
.
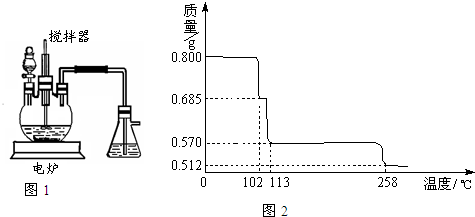
(4)将0.80g CuSO
4?5H
2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图2所示.
①由图2中可以看出,CuSO
4?5H
2O分解的最低温度是
102℃
102℃
.
②试通过计算确定238℃时固体物质的化学式.(要计算过程)
③将CuSO
4?5H
2O固体加热到570℃分解后,得到的主要产物是黑色粉末、硫的最高价氧化物和水蒸气,该反应的化学方程式为
.


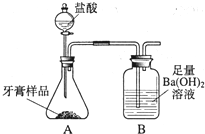 化学兴趣小组对某品牌牙膏中碳酸钙含量进行以下探究.该牙膏摩擦剂主要由碳酸钙、氢氧化铝组成,其他成分遇到盐酸时无气体生成.现利用如图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定B中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数.请回答下列问题.
化学兴趣小组对某品牌牙膏中碳酸钙含量进行以下探究.该牙膏摩擦剂主要由碳酸钙、氢氧化铝组成,其他成分遇到盐酸时无气体生成.现利用如图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定B中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数.请回答下列问题.