
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 实验方法和步骤 | 实验现象(预期) | 分析 |
分别取上述红色溶液于两支试管中,分别在与空气接触和隔绝空气的条件下放置,观察 (或分别在冷却与不冷却的条件下放置) 分别取上述红色溶液于两支试管中,分别在与空气接触和隔绝空气的条件下放置,观察 (或分别在冷却与不冷却的条件下放置) |
前者褪色,后者不褪色 前者褪色,后者不褪色 |
空气中的二氧化碳使溶液的碱性减弱,导致红色褪去(或温度降低使溶液的碱性减弱) 空气中的二氧化碳使溶液的碱性减弱,导致红色褪去(或温度降低使溶液的碱性减弱) |
查看答案和解析>>
科目: 来源: 题型:
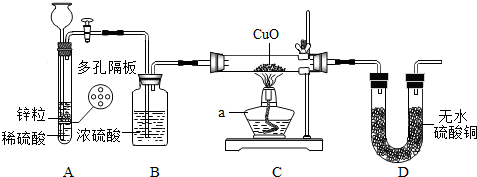
查看答案和解析>>
科目: 来源: 题型:
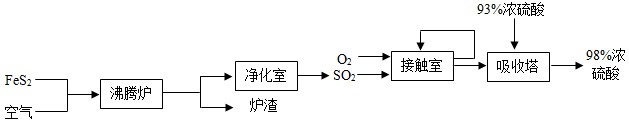
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com