叠氮化钠(NaN
3)被广泛应用于汽车安全气囊,某化学小组同学对其进行下列研究.
[查阅资料]
①NaN
3受撞击会生成Na、N
2.
②NaN
3遇盐酸、H
2SO
4溶液无气体生成.
③碱石灰是CaO和 NaOH的混合物.
④NaN
3的制备方法是:将金属钠与液态氨反应制得NaNH
2,再将NaNH
2与N
2O反应可生成NaN
3、NaOH和氨气(NH
3).
[问题探究]
(1)汽车经撞击后,30毫秒内引发NaN
3迅速分解,写出该反应的化学方程式:
.
(2)工业级NaN
3中常含有少量的Na
2CO
3,其原因是(用化学方程式表示):
2NaOH+CO2═Na2CO3+H2O
2NaOH+CO2═Na2CO3+H2O
.
(3)为测定某工业级NaN
3样品中含有Na
2CO
3的质量分数,化学小组同学设计了如下实验装置.
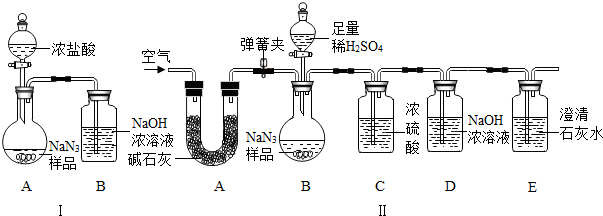
①小明同学认为通过测定装置 I中反应前后B的质量差,再通过相应计算,就可测定Na
2CO
3的纯度,小组内同学通过讨论认为不可以,其理由可能是
浓盐酸有挥发性,挥发出的氯化氢气体会带来实验误差
浓盐酸有挥发性,挥发出的氯化氢气体会带来实验误差
.
②小刚同学在大家讨论的基础上,设计了装置II.请分析:装置II中A的作用
吸收空气中的二氧化碳和水
吸收空气中的二氧化碳和水
;若无装置C,对测定结果造成的影响是
偏大
偏大
(填“偏大”、“偏小”或“无影响”);
③根据装置II,小组同学设计的实验步骤有:
a.称量装置D.
b.称量样品,检查装置气密性.
c.打开弹簧夹,鼓入空气.
d.打开分液漏斗的活塞和玻璃塞,注入足量的稀硫酸,关闭活塞和玻璃塞.
其正确顺序为
bcadca
bcadca
(填字母序号,可重复).
(4)该小组对某一工业级NaN
3样品进行检测.取100克该样品于烧杯中,加水将其溶解,然后逐滴加入一定溶质质量分数的稀硫酸并不断振荡.
首先发生的反应是:2Na
2CO
3+H
2SO
4=2NaHCO
3+Na
2SO
4;
然后发生的反应是:2NaHCO
3+H
2SO
4=Na
2SO
4+2H
2O+2CO
2↑;
在上述过程中生成二氧化碳的质量与加入稀硫酸质量的关系如图甲所示.

①请你根据以上信息,在图乙的坐标系中画出检测过程中烧杯中溶液的质量随滴加硫酸溶液质量的变化曲线.
②计算该样品中纯碱的质量分数.