
科目: 来源: 题型:阅读理解

查看答案和解析>>
科目: 来源: 题型:
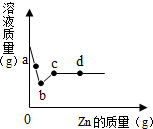 (2013?仪征市二模)向一定质量AgNO3和Cu(NO3)2的混合溶液中加入Zn,与两种溶质依次发生反应.溶液质量与加入Zn的质量关系如图所示,有关说法正确的是( )
(2013?仪征市二模)向一定质量AgNO3和Cu(NO3)2的混合溶液中加入Zn,与两种溶质依次发生反应.溶液质量与加入Zn的质量关系如图所示,有关说法正确的是( )查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| ||
| ||
| ||
| ||
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
 (2011?鸡西一模)如图,塑料垃圾在我们的身边随处可见,这些塑料在自然环境中很难降解,人们把这些废弃塑料带来的污染称为“白色污染”.“白色污染”会破坏土壤,污染地下水,危害海洋生物的生存,焚烧还会污染大气.为保护好我们的环境,保障人体健康,请你提出三点解决“白色污染”问题的建议.
(2011?鸡西一模)如图,塑料垃圾在我们的身边随处可见,这些塑料在自然环境中很难降解,人们把这些废弃塑料带来的污染称为“白色污染”.“白色污染”会破坏土壤,污染地下水,危害海洋生物的生存,焚烧还会污染大气.为保护好我们的环境,保障人体健康,请你提出三点解决“白色污染”问题的建议.查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
 (2011?鸡西一模)如图,由于当今世界经济的飞速发展,一些废气的排放,导致全球变暖,极地的冰川、冰帽开始融化,人类的朋友北极熊已快无家可归了.为了保护我们的家园,让人类的朋友北极熊能有个安稳的家,世界气候大会于2009年在丹麦的首都哥本哈根召开,此次会议上提出了一个新的理念“低碳生活”,你知道“低碳生活”的概念吗?
(2011?鸡西一模)如图,由于当今世界经济的飞速发展,一些废气的排放,导致全球变暖,极地的冰川、冰帽开始融化,人类的朋友北极熊已快无家可归了.为了保护我们的家园,让人类的朋友北极熊能有个安稳的家,世界气候大会于2009年在丹麦的首都哥本哈根召开,此次会议上提出了一个新的理念“低碳生活”,你知道“低碳生活”的概念吗?查看答案和解析>>
科目: 来源: 题型:
 (2011?鸡西一模)如图是集满CO2的矿泉水塑料瓶,打开瓶盖向其中加入少量澄清的石灰水,盖紧瓶盖并振荡塑料瓶,你能看到的现象是什么?并写出有关反应的化学方程式.
(2011?鸡西一模)如图是集满CO2的矿泉水塑料瓶,打开瓶盖向其中加入少量澄清的石灰水,盖紧瓶盖并振荡塑料瓶,你能看到的现象是什么?并写出有关反应的化学方程式.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com