
科目: 来源: 题型:
| 污染源 | 防治建议 | |
| 生活中 | 含磷洗衣粉 生活污水 生活污水 |
少用或不用 处理后再排放 处理后再排放 |
| 生产中 | 工业产生的废水 滥用农药、化肥 滥用农药、化肥 |
经处理后再排放 农药、化肥合理使用 农药、化肥合理使用 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:阅读理解
| 商品名称 | 小苏打 | 食臭粉 | 混合碱性膨松剂 |
| 主要成分 | 碳酸氢钠 | 碳酸氢铵 | 碳酸氢钠和碳酸氢铵 |
| ||
| ||
| 实验序号 | 实验装置 | 实验现象 | 实验结论剂分析 |
| 实验1 | 选用A,B,C | C中澄清石灰水变浑浊 | 有CO2生成,C中反应的化学方程式是 Ca(OH)2+CO2═CaCO3↓+H2O Ca(OH)2+CO2═CaCO3↓+H2O |
| 实验2 | 选用A, D D 和E |
E中紫色石蕊溶液变成 蓝 蓝 色 |
有NH3生成. |
| 实验序号 | 实验目的 | 实验装置 | 数据记录 | 实验结论 |
| 实验3 | 测定生成CO2的质量 | 选用A、B、D | 装置D增重ag | 该粉末为“混合碱性膨松剂” |
| 实验4 | 测定生成NH3的质量 | 选用A、B、D | 装置B增重1.7g |

查看答案和解析>>
科目: 来源: 题型:阅读理解
| 实验装置 | 实验操作和现象 | |
| 第 一 组 |
 |
冷却至室温,打开K.A中水倒吸入集气瓶内约30mL,B中水倒吸入集气瓶内约50 mL |
| 第 二 组 |
 |
①冷却至室温,打开K,CD均无明显变化, ②关闭K,分别将2mL的溶液滴入集气瓶,一段时间后打开K.C中部分水倒吸入集气瓶中,D中的水不倒吸 ③将装置D中的集气瓶放在盛有冰水的水槽中.部分水倒吸入集气瓶中. |
| ||
| ||
查看答案和解析>>
科目: 来源: 题型:
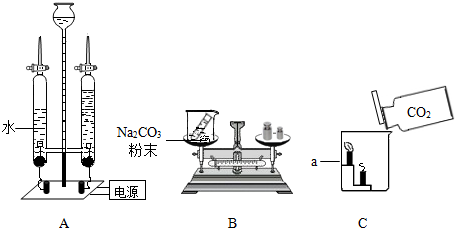
| ||
| ||
查看答案和解析>>
科目: 来源: 题型:
| ||
| ||
| ||
| ||
查看答案和解析>>
科目: 来源: 题型:
 (2013?西城区二模)我国古代纺织业常将草木灰(主要成分K2CO3)和生石灰在水中混合,用上层清液漂白织物.
(2013?西城区二模)我国古代纺织业常将草木灰(主要成分K2CO3)和生石灰在水中混合,用上层清液漂白织物.| 温度/℃ | 0 | 10 | 20 | 30 | 50 | |
| 溶解度/g | Ca(OH)2 | 0.18 | 0.17 | 0.16 | 0.15 | 0.14 |
| k2CO3 | 107 | 109 | 110 | 114 | 121 | |
| KOH | 97 | 103 | 112 | 126 | 140 | |
查看答案和解析>>
科目: 来源: 题型:
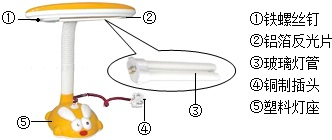 (2013?西城区二模)金属在生产和生活中有广泛的应用.
(2013?西城区二模)金属在生产和生活中有广泛的应用.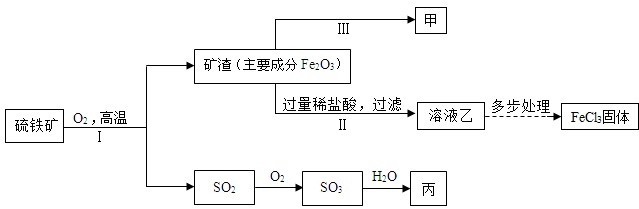
| ||
| ||
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com