
科目: 来源: 题型:
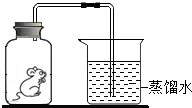 将一只小白鼠放在集气瓶中,并密封(如图),发现小白鼠仍可存活一段时间.
将一只小白鼠放在集气瓶中,并密封(如图),发现小白鼠仍可存活一段时间.查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 物质 | 醋 | 肥皂水 | 食盐水 | 牙膏 |
| pH | 3 | 10 | 7 | 9 |
查看答案和解析>>
科目: 来源: 题型:
在一定条件下,一个密闭容器内发生某反应,测得反应过程中各物质的质量部分数据如下表所示.下列未知数据计算正确的是( )
|
查看答案和解析>>
科目: 来源: 题型:阅读理解
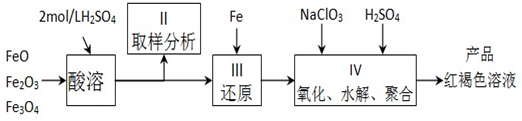
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com