
科目: 来源: 题型:阅读理解
亚硝酸钠(NaNO2)是一种外观极像食盐,且具有与食盐一样咸味的有毒物质,因此这种工业用盐常被误作食盐使用,导致多起中毒事故发生。请你阅读下表有关资料,并结合已有化学知识,设计三种实验方案鉴别一包外观极像食盐的样品是亚硝酸钠,还是氯化钠。
| 项目 | 亚硝酸钠 | 氯化钠 |
| ||
| 15℃时的溶解度/g | 81.5 | 35.8 |
| ||
| 熔点/℃ | 271 | 801 |
| ||
| 沸点/℃ | 320℃时发生分解,放出有臭味的气体 | 1412 |
| ||
| 水溶液的酸碱性 | 碱性 | 中性 |
| ||
| |||||
| 方案 | 实验步骤 | 预期的实验现象和结论 | |||
| l | |||||
| 2 | |||||
| 3 | |||||
查看答案和解析>>
科目: 来源: 题型:阅读理解
【研究课题】:探究热水壶底部水垢的主要成分
【查阅资料】:该小组同学通过查阅资料知道,天然水中一般都含有Ca2+、Mg2+、HCO3-等离子,在加热时,这些离子趋于生成溶解度更小的物质――水垢(主要成分为碳酸盐、碱的混合物)。同时,他们还查阅到下列有关物质的溶解性:
| 物质 | Ca(HCO3)2 | Mg(HCO3)2 | Ca(OH)2 | Mg(OH)2 | CaCO3 | MgCO3 |
| 溶解性 | 可溶 | 可溶 | 微溶 | 不溶 | 不溶 | 微溶 |
【提出猜想】:水垢的主要成分一定含有Mg(OH)2和 ,可能含有Ca(OH)2和 。
【设计方案】:
(1)甲同学在烧杯中放入少量研碎的水垢,加入适量蒸馏水充分搅拌,取上层清液加入 ,没有白色沉淀,说明水垢中无Ca(OH)2;
(2)乙同学设计下列实验装置,进一步确定水垢中含有碳酸盐的成分,步骤如下:
①按图组装仪器,将50g水垢试样放入锥形瓶中,加入足量某酸溶液;
②测量一定时间内干燥管内物质增加的质量(见下列曲线);
③待锥形瓶中不再产生气泡时,打开活塞B,从导管A处缓缓鼓入一定量的空气;
④再次称量干燥管内物质增加的质量;
⑤重复③和④的操作,直至干燥管内物质质量不变。
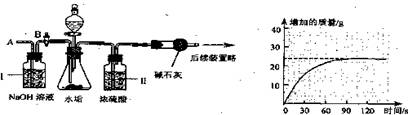
a.步骤①所加的酸溶液是 ;
b.装置Ⅱ的作用是 ;从导管A处缓缓鼓人一定量的空气时,装置I的作用是 ;
c.研究性小组的同学经过简单计算,认为水垢中一定含有MgCO3,理由是 。
【实验结论】通过上述探究可知:水垢的主要成分有 。
查看答案和解析>>
科目: 来源: 题型:
某同学将一小包铜粉和锌粉的混合物放入一定量的硝酸银溶液中,使其充分反应后过滤,得到固体和蓝色滤液,并对滤液的组成进行探究。
(1)锌和硝酸银溶液反应的化学方程式 。
(2)同学们对滤液中所含的溶质做出多种猜想,其中有两种猜想可能成立,这两种猜想是:
①溶质为 ;②溶质为 。
| 方案 | 实验操作 | 实验现象 | 结 论 |
| 方案一 | 猜想 成立 | ||
| 方案二 | 猜想 成立 |
查看答案和解析>>
科目: 来源: 题型:
甲酸(HCOOH)通常是一种无色易挥发的液体,它在浓硫酸作用下易分解,反应方程式为:HCOOH![]() CO↑+H2O。某课外活动小组的同学欲用该反应来制取CO,并还原红棕色的氧化铁粉末。现有下列仪器或装置供选择:
CO↑+H2O。某课外活动小组的同学欲用该反应来制取CO,并还原红棕色的氧化铁粉末。现有下列仪器或装置供选择:
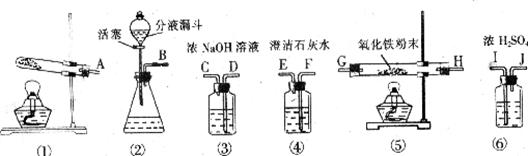
(1)用甲酸滴入浓硫酸的方法制取CO,应选 (填序号)装置;如果要除去CO气体中混有少量的甲酸,最好选择上图中 (填序号)进行洗气。
(2)用上述方法制取的CO还原氧化铁,并检验气体产物,则各仪器的接口连接顺序为 ___________________________________________(填字母)。
(3)在对氧化铁粉末加热前,为安全起见,应进行的一项重要操作是 。
(4)从开始加热到实验结束,氧化铁粉末的颜色变化为 ,反应方程式为 。
(5)上述实验的尾气不能直接排放到空气中,请你说出一种处理尾气的方法: 。
查看答案和解析>>
科目: 来源: 题型:
小明同学在使用“除垢净”去除热水壶中的水垢时,发现有大量的气泡产生,联想水垢的主要成分是碳酸钙。小明猜想“除垢净”的成分中可能有酸。
①为证实自己的猜想,小明从家中又找来两类不同的物质进行实验:
实验一: ;
实验二: 。
经实验,小明得出“除垢净”的有效成分中一定有酸的结论。
②小明想试制一瓶“除垢净”,你认为HCl、H2SO4两种酸中的 更合适,理由是 。
③结合上面对“除垢净”的了解,在使用“除垢净”时应注意 。
查看答案和解析>>
科目: 来源: 题型:
小明、小鹏和小芳三位同学在一起探究蜡烛燃烧,他们将短玻璃导管插入焰心,发现另一端也可以点燃。
(1)【提出问题】导管里一定有可燃性气体,气体成分可能会是什么呢?
(2)【猜想】小明认为:可能是蜡烛不完全燃烧时产生的CO。
小鹏认为:可能是蜡烛受热后产生的蒸气。
小芳认为:可能上述两种情况都有。
(3)【设计实验方案】请你帮助他们设计一个简单的实验方案,来判断哪一种分析是正确的_____________________________________________________________________________。
(4)【现象与结论】如果小明的猜想正确,现象应是 。
如果小鹏的猜想正确,现象应是 。
如果小芳的猜想正确,现象应是 。
(5)如果用CnH2n+2表示蜡烛的主要成分,其燃烧的化学方程式为: 。
查看答案和解析>>
科目: 来源: 题型:
自然界的矿物中有一种重晶石矿,它的主要成分是BaSO4,它不溶于任何酸、碱和水,纯净的硫酸钡可供医疗等方面应用。某同学用重晶石和焦炭为原料,制取纯净硫酸钡,部分流程如下(设矿物中杂质不与焦炭反应,也不溶于水):
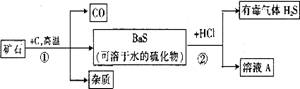
(1)步骤①中,哪些元素的化合价升高,哪些元素的化合价降低? ;
(2)步骤②中溶液A中溶质的化学式: ;
(3)写出利用溶液A中的溶质为主要原料制取BaSO4的化学方程式: ;
(4)步骤②产生有毒气体H2S,应加以改进,为使实验既不产生H2S又能获得纯净BaSO4,请你提出改进意见 ;有关反应的化学方程式是 。
查看答案和解析>>
科目: 来源: 题型:
将一种盐溶于水,会使水的冰点(凝固点)降低,冰点降低多少与盐在溶液中的质量分数有关。如果将此盐溶液降温。则在零度以下某温度会析出冰。但当盐在溶液中的质量分数比较大时,在将溶液冷却的过程中先析出的固体不是冰而是盐的晶体。如图所示,横坐标为氯化钙溶液中溶质的质量分数,纵坐标为温度,试填空或简答:

(1)氯化钙溶液可用作冷冻剂,当无水氯化钙与水混合的质量比为 时(填写最简整数比),冷却效果最好。
(2)指出两条曲线分别表示的具体含义:
曲线AB: ;
曲线BC: 。
(3)将10℃时38%的氯化钙溶液降温到40℃时,下列有关说法正确的是 (填序号)。
A.此时溶液处于不饱和状态
B.溶液中析出了氯化钙晶体
C.溶液中已经有冰析出
D.此时冰、氯化钙晶体和氯化钙饱和溶液共存
E.此时氯化钙晶体和氯化钙饱和溶液共存
查看答案和解析>>
科目: 来源: 题型:
粉笔是教室内空气的主要污染物(可吸入颗粒物),粉笔的生产过程是:
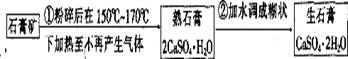
(1)写出熟石膏变成生石膏的化学方程式。
(2)在熟石膏中加入少量的甘油和纯碱,可制成“无尘”粉笔,这是利用甘油吸湿性很强的性质,可使粉笔因潮湿而不飘尘。而加入纯碱的作用是提高粉笔的硬度。其原理用化学方程式表示为 。
查看答案和解析>>
科目: 来源: 题型:
2006年10月12日“神舟六号”发射成功,标志着我国航天事业的新跨越。
(1)火箭推进器中盛有强还原剂联氨(N2H4)和双氧水(H2O2),它们混合时产生水蒸气和一种单质,并放出大量的热,其反应的化学方程式为 ;将联氨作推进器中燃料的一个很大优点是 。
(2)宇宙飞船中用来除去二氧化碳的物质是氢氧化锂(LiOH),其反应原理是 ;用氢氧化锂而不用其他物质(如氢氧化钠)的原因是 (通过计算说明) 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com