
科目: 来源: 题型:
抗甲型H1N1流感的有效药物达菲可用莽草酸(C7H10O5)制取。有关莽草酸的正确说法是 ( )
A.莽草酸是氧化物 B.莽草酸由碳、氢、氧三种元素组成
C.莽草酸各元素的质量比为7:10:5 D.每个莽草酸分子里含有5个氢分子
查看答案和解析>>
科目: 来源: 题型:
将光亮洁净的铁丝浸入硫酸铜和硫酸锌的混合溶液中,一段时间后取出,铁丝表面覆盖了一层物质,这层物质是 ( )
A.Zn B. Cu C.Zn和 Cu D.Fe 和Zn
查看答案和解析>>
科目: 来源: 题型:
物质性质决定它的用途,还决定了它的保存方法。固体NaOH具有以下性质:
①白色固体 ②易溶于水,溶解放热 ③易吸收水而潮解 ④有腐蚀性
⑤能与空气中的二氧化碳反应。实验室必须将它密封保存的主要原因是: ( )
A.③⑤ B.①②③ C. ②③④ D.①②
查看答案和解析>>
科目: 来源: 题型:
过氧化钙(CaO2)广泛应用于水产养殖、污水处理等领域,是优良的供养剂。
【制备CaO2】工业制备过氧化钙的一种![]() 方法是氢氧化钙法。
方法是氢氧化钙法。
(1)Ca(OH)2和H2O2在有水存在的条件下生成Ca![]() O2·8H2O,它在120℃时完全分解为CaO2等。有关化学反应方程式为: , 。
O2·8H2O,它在120℃时完全分解为CaO2等。有关化学反应方程式为: , 。
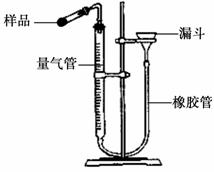
【测定CaO2纯度】CaO2在350℃时能迅速分解,生成CaO和O2。右图是实验室测定产品中CaO2含量的装置。
(2)检查装置![]() 气密性的方法是:连接好装置,从漏斗注水,量气管两边形成高度差,做好标记,一段时间后,高度差 ,说明气密性良好。
气密性的方法是:连接好装置,从漏斗注水,量气管两边形成高度差,做好标记,一段时间后,高度差 ,说明气密性良好。
(3)正确读取量气管内液面的初始、最终读数前都![]() 需进行的操作是 。
需进行的操作是 。
(4)加热小试管时,随着过氧化钙分解,量气管内的 液面逐渐下降,为防止试管和量气管内气体压强 过大,可将漏斗 (填“上提”或“下移”)。
(5)计算含量需要测定的数据有 。(填字母序号)
A. 氧气的体积 B. 样品的质量 C. 反应的时间
(6)若样品质量为0.20 g,反应前量气管读数为2.10 mL,反应后量气管读数为24.50 mL(常温下氧气的密度为1.429g/L)。实验中量气管的最佳规格是 。(填字母序号)
A.50 mL B.100 mL C.1 L
(7)样品中CaO2含量为 。
(8)若样品质量用w表示,反应前称量药品和小试管总质量为m g,反应后在空气中冷却,称量药品和小试管总质量为n g,则CaO2含量=![]() 。此方案测定结果偏小的原因可能是 。
。此方案测定结果偏小的原因可能是 。
查看答案和解析>>
科目: 来源: 题型:阅读理解
化学中质量守恒定律是一个非常重要的定量定律。
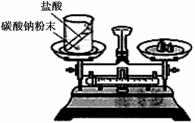
(1)如右图装置中,称量小烧杯中所有物质的质量m1,然后将小烧杯中的碳酸钠与盐酸完全混合,反应发生一段时间后,再称量小烧杯及烧瓶内物质的总质量为 m2,则(填“=” “>”“<”)m1 m2 ,其原因为 。
(2)天然气的主要成分是甲烷(CH4),可直接用作气体燃
料。燃烧反应前后分子种类变化的微观示意图如下所示。
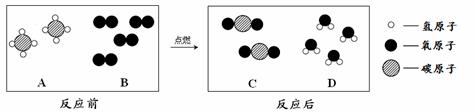
①1个B分子中含有 个原子。
②四种物质中属于化合物的是 (填图中字母)。
(3)A和B可发生如下反应:3A+2B=A3B2,某学生做了3次该实验(每次均充分反应),反应前A和B的质量![]() 和都是l0g。有关实验数据见下表:
和都是l0g。有关实验数据见下表:
| 序号 | 反应前A的质量 | 反应前B的质量 | 反应后A3B2的质量 |
| ① | 8g | 2g | 6g |
| ② | 4g | 6g | 6g |
| ③ | xg | yg | 9g |
X∶Y的比值可能为 或 。
(4)为了测定某品牌食用纯碱中碳酸钠的质量分数,某校化学研究性学习小组的探究过程如
下:
【提出问题】样品中碳酸钠的质量分数是多少?
【知识准备】食用纯碱的主要成分是碳酸钠,另外还含有少量的氯化钠;反应过程中不考虑水和氯化氢的挥发。
【设计方案】(1)方案一:向一定量样品中加入过量澄清石灰水,根据反应生成碳酸钙的质量,先求出碳酸钠的质量,再计算样品中碳酸钠的质量分数。
(2)方案二:向一定量样品中加入足量的稀盐酸,根据反应生成二氧化碳的质量,先求出碳酸钠的质量,再计算样品中碳酸钠的质量分数。
【进行实验】甲组同学:称取24.00g样品,加水配成溶液,在溶液中加入过量的澄清石灰水。过滤、洗涤、干燥,共得到白色沉淀20.00g。
乙组同学:称取24.00g样品,加入足量的稀盐酸直到反应停止,共收集到8.80g二氧化碳。
【解决问题】请你任选一组同学的实验结果,帮助他们计算出样品中碳酸钠的质量分数。(写出计算过程。计算结果精确到0.1% )
查看答案和解析>>
科目: 来源: 题型:
某兴趣小组同学发现实验台上整齐摆放的药品中(见下图),有一试剂瓶的标签破损。
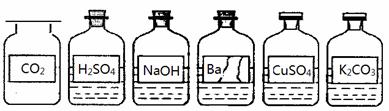
【提出问题】这瓶试剂的成分是什么?
【设计并实验】
(1)小明用洁净干燥的玻璃棒蘸取该溶液滴到湿润的pH试纸上,测得pH=10,他判断这是一种碱性溶液。对他的操作方法、测量结果及结论的评价,正确的是 ;
A.方法正确,结果正确,且结论正确 B.方法不正确,结果偏小,但结论正确
C.方法不正确,结果偏大,结论不正确 D.方法正确,结果正确,但结论不正确
(2)小明认为它是Ba(OH)2溶液,小俊认为它是Ba(NO3)2溶液。要进一步确定它的成分,小俊认为只需选择上图已有的试剂就能把它鉴别出来。他们又进行了实验。
| 操作步骤 | 实验现象 | 结论及化学方程式 |
| 取样滴入盛有二氧化碳的集气瓶中 |
| 猜想正确 相关的化学方程式 |
【知识升华】
(3)我能写出其中符合下列条件的化学方程式,
①有白色沉淀的中和反应:
②硫酸铜溶液与氢氧化钡溶液之间反应:
(4)我发现NaOH和H2SO4溶液能发生复分解反应,因为溶液中的H+和OH—不能大量共存;我还发现在溶液中 和 ; 和 (填离子符号)也不能大量共存。
查看答案和解析>>
科目: 来源: 题型:
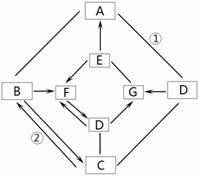
A~G均为初中常见的化学物质(“→”表示物质 间的转化关系,“—”表示两端的物质能发生化学反应),其中A、F是初中阶段常见的两种氧化物;B、D是初中阶段常见的两种碱; G是一种常见的建筑材料,E是人体胃液中的一种酸,它们之间有如下图的相互转化关系(图中部分生成物已略去)。请回答下列问题:
(1)B物质的俗称是_ ,
(2)C的化学式为__ 。
(3)写出化学反应①和②的化学方程式:
①__ ![]() ____;②____ _______。
____;②____ _______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com