
科目: 来源: 题型:阅读理解
空气中的SO2含量和可吸入颗粒的含量(可用g/cm3表示)都是重要的空气质量指标。在工业生产上规定:空气中二氧化硫的最大允许排放浓度不得超过0.02 mg/L。《2004年江苏省环境状况公报》指出:江苏省2004年工业(主要是热电厂)二氧化硫排放总量为1.24×106t,全省酸雨污染比较严重。分析降雨成分发现,雨水中阴离子仍以硫酸根离子为主,约占阴离子总量的61.9%。
(一)(1)正常的雨水显 性(填:酸、碱、或中),原因是 ;
(2)由于大气中SO2和NOx(NO和NO2)的含量不断升高,并转变为H2SO4型和HNO3型雨水降落而形成的。我省主要是硫酸型酸雨。我省这种酸雨形成过程有两种途径:一种是SO2在空气中的飘尘做催化剂的作用下被氧气氧化为SO3,溶于水生成硫酸,写出有关的反应化学方程式 、 ;
另一种是SO2溶于水生成亚硫酸,再被空气中的氧气氧化成硫酸,写出有关的反应化学方程式 、 。由于SO2的氧化非常缓慢,故后一种途径是其主要形成过程。
(3)兴趣小组同学取刚降到热电厂附近的雨水进行测定,每隔五分钟测一次pH,其数据如下表所示:
| 测定时刻 | 5∶05 | 5∶10 | 5∶15 | 5∶20 | 5∶25 | 5∶30 | 5∶35 |
| pH | 4.95 | 4.94 | 4.94 | 4.88 | 4.86 | 4.85 | 4.85 |
分析上述数据变化,你可以得出的结论是 ;针对此结论,你猜测其中的原因为 。结合大理石被酸雨腐蚀的事实,你认为碳酸、硫酸、亚硫酸酸性由强到弱的顺序为__________________________。
(二)SO2气体能使品红溶液、高锰酸钾溶液褪色。

回答以下问题:
(1)单独检查装置C的气密性的操作是:关闭活塞b,然后________________________ ,
若发现________________,说明装置C气密性良好。
(2)实验室用Na2SO3固体和硫酸溶液制取SO2气体,应选用__________(选“A”或“C”)做气体发生装置,不选用另一装置的理由是 。
(3)小组的同学在A、C装置中的另一个用块状FeS固体和稀硫酸制取H2S气体,反应的方程式为_________________ 。
(4)SO2气体通过D装置时现象是____________________ ,通过E装置时现象是________________ ;SO2与H2S在B装置中反应,生成一种氧化物和一种单质,反应的方程式是 。
(5)F仪器的名称是___________;F中盛有NaOH固体,作用是
(三)⑴为测定某地方的空气中SO2和可吸入颗粒的含量,查阅资料得知:可用含有一定量碘的溶液测定空气中的SO2含量,反应方程式是:SO2+I2+2H2O=H2SO4+2HI。甲同学设计了如下图所示的实验装置:

①应用上述装置测定空气中的SO2含量和可吸入颗粒的含量,除测定气体流速(单位:cm3/min)外,还需要测定吸收前后颗粒吸附剂、棉花、盛放容器的总质量和 。
②已知:碘单质微溶于水,KI可以增大碘在水中的溶解度。
请你协助甲同学完成稀碘溶液的配制:
第一步:准确称取1.27g碘单质加入烧杯中, ;
第二步:加适量水使之完全溶解,然后加水至溶液体积为1000 mL;
第三步:从第二步所得溶液中,取出10.00mL溶液加入稀释至100mL。
⑵乙同学拟用下列简易装置测定空气中的SO2含量:准确取50mL第三步所得的碘溶液,注入右图所示广口瓶中,加2~3滴淀粉指示剂,此时溶液呈蓝色。在指定的测定地点抽气,每次抽气100mL,直到溶液的蓝色全部褪尽为止,记录抽气次数(n)。
假设乙同学的测量是准确的,乙同学抽气的次数为80次,计算说明该地空气中的SO2含量是否符合排放标准。(写出解题过程,此题3分)

⑶该小组同学认为这些工厂要对排出的废气进行处理,为了达到最好效果,在实验室进行了实验模拟,你认为他们为了吸收产生的SO2气体,所使用药品应该是________,发生的化学反应方程式______________________________________
经过再三思考,设计了以下装置,认为下列哪种不能采用______,因为其他装置都具有________作用。

A B C D E F G H I J
查看答案和解析>>
科目: 来源: 题型:阅读理解
氢氧化铜固体受热分解能得到两种氧化物,一种为固体,另一种是无色液体。某化学活动小组为确定这种固体产物是什么,进行了如下探究活动。
《假设》:生成的固体产物 ①可能是氧化亚铜(Cu2O)(红色) ;
②可能是 。
《设计实验》:小明用氢氧化钠溶液与硫酸铜溶液
反应制得氢氧化铜,放入试管中,使其在加热条件下分解(如下图),观察到蓝色粉末逐渐变成黑色。

请指出仪器名称:a ,b 。
《推测结论》:猜想______成立。
《形成结论》:写出氢氧化铜受热分解的化学方程式:_______________________________。
《查阅资料》知:(1)此黑色固体可用氢气还原,则小明选择下列________装置进行实验;
(2)已知Cu2O有如下性质:Cu2O+H2SO4==Cu+CuSO4+H2O,在用氢气还原黑色固体后得到的铜中常混有少量Cu2O,取此Cu和Cu2O的
混合物共10g放入足量的稀硫酸中充分反应, 过滤得9.5g固体,则此混合物中Cu2O的质量分数为________。
《拓展与思考》:小华也用氢氧化钠溶液与硫酸铜溶液反应,但得到的沉淀不呈蓝色,而是浅绿色的;他又将此浊液加热直至沸腾,观察不到有分解变黑的迹象。为什么?小华查找资料得知,该浅绿色沉淀物是溶解度极小的碱式硫酸铜,其化学式为Cu4(OH)6SO4,同时还生成硫酸钠;此浅绿色沉淀能与酸反应,形成蓝色溶液。则碱式硫酸铜中铜元素的化合
价为______,请帮小华写出生成浅绿色沉淀的有关反应的化学方程式:_________________。
小华想设计一个实验,证明该浅绿色沉淀中含有硫酸根, 于是将沉淀过滤、洗涤,把沉淀再溶解在足量的无色溶液A中,取所得溶液滴加无色溶液B,若有大量白色沉淀生成,则表示原浅绿色沉淀中有SO42-,试推测:(1)无色溶液A的化学式是 ,无色溶液B的化学式是 ;
(2)写出产生白色溶液的化学方程式 。
查看答案和解析>>
科目: 来源: 题型:阅读理解
天然气的主要成分是甲烷(CH4),甲烷不仅是一种很好的燃料,而且是一种重要的化工原料。请你根据下列信息回答问题:
(1)甲烷在高温下可以分解为炭黑和氢气,炭黑可用来制造高级油墨。甲烷分解的化学方程式为:CH4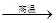 C+2H2,进行该反应必须使甲烷处于特别的环境中,你认为此处所指的特别环境是 。 (2)甲烷与氯气(C12)混合后在光照下可以发生下列反应:CH4+Cl2
C+2H2,进行该反应必须使甲烷处于特别的环境中,你认为此处所指的特别环境是 。 (2)甲烷与氯气(C12)混合后在光照下可以发生下列反应:CH4+Cl2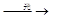 CH3Cl+HCl CH3C1+Cl2
CH3Cl+HCl CH3C1+Cl2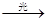 CH2Cl2+HCl CH2Cl2+Cl2
CH2Cl2+HCl CH2Cl2+Cl2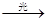 CHCl3+HCl CHCl3+Cl2
CHCl3+HCl CHCl3+Cl2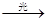 CCl4+HCl
CCl4+HCl
常温下,CH3Cl是气体,CH2Cl2、CHCl3、CCl4都是液体。CCl4可用于灭火,其原因是 (选填下列选项的序号)。
A.CCl4是液体 B.CCl4含有Cl元素 C.CCl4中碳元素已经是最高的+4价,最稳定 D.CCl4的相对分子质量最大
(3)把CH3Cl缓慢通入被加热的烧碱溶液中,发生的反应为:CH3Cl+NaOH CH3-OH
CH3-OH
+NaCl+H2O。为了验证该反应的存在,某化学兴趣小组的同学做了下列实验:
①把一定量的CH3Cl缓慢通入被稀硝酸酸化的AgNO3溶液中,无白色沉淀产生,CH3C1全部从溶液中逸出。②把—定量CH3Cl缓慢通入被加热的烧碱溶液中,有少部分CH3Cl从溶液中逸出。一段时间后停止加热,待溶液温度降到接近室温后,取少量反应后的混合液于另一试管中,滴加稀硝酸至溶液呈酸性,再滴入AgNO3溶液,发现有白色沉淀产生。
该实验第①步的目的是 ,该实验现象说明了什么? 。
实验②中,滴加稀硝酸至溶液呈酸性的原因是
。
查看答案和解析>>
科目: 来源: 题型:
随着“绿色奥运”的理念逐渐深入人心,空气质量日益受到人们的关注。下列物质中,未计入监测空气污染指数项目的是 ( )
A.氮气 B.二氧化硫 C.一氧化碳 D.可吸入颗粒物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com