酸雨是大气污染的危害之一,二氧化硫(SO
2)的含量是空气质量监测的一个重要指标。某兴趣小组同学收集某地的雨水进行实验。
【相关信息】①每隔1 h,通过pH计测定雨水样品的pH,测得的结果如下表:
测定时间/h
| 0
| 1
| 2
| 3
| 4
|
雨水样品的pH
| 4.73
| 4.62
| 4.56
| 4.55
| 4.55
|
②SO
2能使品红溶液褪色;
③pH<5.6的雨水为酸雨;
④海水呈弱碱性;
⑤BaSO
3不溶于水,能与盐酸反应;BaSO
4不溶于水,也不溶于盐酸。
【分析讨论】①正常雨水的pH范围是:7> pH> 5.6,偏酸性,这是因为
▲ 。
②酸雨能腐蚀金属制品,从基本反应类型上看主要反应属于
▲ 。
③收集的酸雨样品放置一段时间后pH减小,原因是SO
2与水反应生成的H
2SO
3被氧化为H
2SO
4。试写出该反应的化学方程式
▲ 。
【提出猜想】同学们对刚收集到的酸雨样品中的溶质进行猜想:
猜想Ⅰ:酸雨中溶质只含有H
2SO
3;
猜想Ⅱ:酸雨中溶质只含有H
2SO
4;
猜想Ⅲ:酸雨中溶质
▲ 。
【实验探究】
(1)向刚收集的酸雨样品中滴加过量Ba(OH)
2溶液,有白色沉淀生成,过滤。
①在滤液中滴加
▲ 溶液,溶液呈
▲ 色。证明在酸雨样品中滴加的Ba(OH)
2溶液已过量。
②向沉淀中加入足量盐酸,沉淀部分溶解且放出有刺激性气味气体。该反应的化学方程式为
▲ ,根此现象有关酸雨中溶质的猜想
▲ 正确。
(2)某同学取酸雨样品
V L,加入17.1%的Ba(OH)
2溶液至不再产生沉淀时,恰好消耗10.00 g Ba(OH)
2溶液。该
V L酸雨样品中溶解SO
2的质量为
▲ 。
【实验反思】在某些酸雨中还可分析出有硝酸存在,这是由于空气中含有某元素+4价氧化物的原因,这种氧化物的化学式为
▲ 。
【拓展延伸】利用海水脱硫是减少SO
2排放的有效方法,其工艺流程如下图所示:
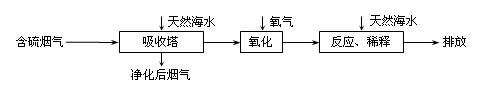
天然海水吸收了较多的含硫烟气后,有H
2SO
3生成,H
2SO
3与海水中的离子反应,会释放出CO
2,通入氧气后氧化后,海水的酸性显著增强。
①设计一种检验净化后的烟气中是否含SO
2的简单的实验方案:
▲ 。
②氧化后的海水需要用大量的天然海水与之混合后才能排放,该操作的主要目的是
▲ 。



