
科目: 来源: 题型:


| A.能杀菌消毒 | B.能得到纯净水 |
| C.能把硬水变为软水 | D.能使河水变得无色澄清 |
查看答案和解析>>
科目: 来源: 题型:
| 1 H | | 2 He | |||||
| 3 Li | 4 Be | 5 B | 6 C | 7 N | 8 O | 9 F | 10 Ne |
| 11 Na | 12 Mg | 13 Al | 14 Si | 15 P | 16 S | 17 Cl | 18 Ar |
 ,则m = ,该原子在化学反应中易
,则m = ,该原子在化学反应中易
查看答案和解析>>
科目: 来源: 题型:


查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:


查看答案和解析>>
科目: 来源: 题型:

|
 应满足的关系是 ___ (取最简整数比)。
应满足的关系是 ___ (取最简整数比)。查看答案和解析>>
科目: 来源: 题型:阅读理解
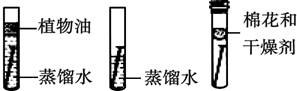
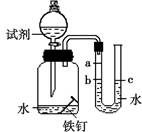
| 影响因素 | 实验设计 | 实验现象 | 实验结论及解释 |
| ①温度 | 装置I放入25℃恒温环境中,装置II放入40℃恒温环境中。 | 两套装置中铁钉均锈蚀,且U型管中液面均由b处上升至a处,则所需时间I>II。 | 锈蚀的速率I<II;铁的锈蚀速率与反应时的温度有关,_______。 |
| ②氧气含量 | _________。 | ________。 | 铁的锈蚀速率与氧气的含量有关,氧气的含量越多,铁的锈蚀越快。 |
| ③水溶液的导电性 | 在相同温度下,装置I集气瓶中加入10mL氯化钠溶液;装置II集气瓶中加入10mL乙醇。 | 两套装置中铁钉均锈蚀; 且U型管中液面均由b处上升至a处,则所需时间I < II。 | _______。 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
 CaO+CO2↑)。现有含杂质10%的石灰石100 t(杂质不参与反应,且不含钙元素),经高温煅烧后,若测得剩余固体中钙元素的质量分数为50%。通过计算回答:
CaO+CO2↑)。现有含杂质10%的石灰石100 t(杂质不参与反应,且不含钙元素),经高温煅烧后,若测得剩余固体中钙元素的质量分数为50%。通过计算回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com