
科目: 来源: 题型:
分析: A组K+和是KClO3电离产物,KClO3属盐,故不应选A。
B组中Cl-和H+,是HCl电离产物,HCl属无氧酸,不应选B。
C组中OH-和Ca2+碱Ca(OH)2电离产物,故也不应选。
D组中H+和是H2SO4电离的产物,故应选D。答案:D
查看答案和解析>>
科目: 来源: 题型:
分析 硫酸和盐酸都能使紫色石蕊试液变红,使无色酚酞试液不变色,所以指示剂无法将它们区分开,故A、B不正确。盐酸与硝酸银溶液反应,生成白色沉淀(AgCl),硫酸与硝酸银反应生成微溶于水的白色沉淀(Ag2SO4),难于区分两者,而盐酸不与氯化钡溶液反应,硫酸则与氯化钡溶液反应产生白色沉底。答案:D
查看答案和解析>>
科目: 来源: 题型:
分析 A中电离出的氢离子的符号应是“H+”,而不是“H+m”,表示m个H+时,m应写在H+前面即mH+,B中氢离子所带电荷数应为1+,而不是m+,C中酸根离子所带电离数m应写在“-”号之前,D是正确的。
查看答案和解析>>
科目: 来源: 题型:
分析 在酸的定义中关键的字是“全部”二字,A中没有指出,所以A是错误的,硫酸氢钠电离时,NaHSO4=H++Na++SO42-,虽然电离出H+,但其阳离子还有Na+,所以它不是酸而是酸式盐,因此B正确。C的说法符合盐的定义,是正确的。酸、碱、盐溶液中,阳离子所带正电荷总数与阴离子所带负电荷总数一定相等,D的叙述是正确的,所以,答案为A。
查看答案和解析>>
科目: 来源: 题型:
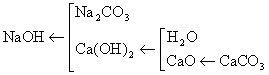 分析:该道题是物质制备题,其解法要用倒推法。从产品火碱出发向原料来推。火碱是一种易溶于水的碱,要制得它必须做到两点:一点是反应物应选一种可溶碱和可溶盐,另一点是生成物除NaOH外另一物质不溶于水,这样一来,不仅能使反应进行,而且便于把NaOH溶液分离出来。通过课本学习,我们不难发现石灰水能跟碳酸钠反应生成不溶于水的CaCO3和NaOH,那么这个反应就作为该题答案的最后一个反应。在该反应中,反应物Na2CO3已经有,Ca(OH)2怎样来,就成了我们第二步任务。由于CaO溶于水可得Ca(OH)2,水已有,但CaO又从何来,这就成了我们第三步的任务。CaO可从CaCO3高温分解来,这样该题就能解了。
分析:该道题是物质制备题,其解法要用倒推法。从产品火碱出发向原料来推。火碱是一种易溶于水的碱,要制得它必须做到两点:一点是反应物应选一种可溶碱和可溶盐,另一点是生成物除NaOH外另一物质不溶于水,这样一来,不仅能使反应进行,而且便于把NaOH溶液分离出来。通过课本学习,我们不难发现石灰水能跟碳酸钠反应生成不溶于水的CaCO3和NaOH,那么这个反应就作为该题答案的最后一个反应。在该反应中,反应物Na2CO3已经有,Ca(OH)2怎样来,就成了我们第二步任务。由于CaO溶于水可得Ca(OH)2,水已有,但CaO又从何来,这就成了我们第三步的任务。CaO可从CaCO3高温分解来,这样该题就能解了。
推导法的解题思路如下:
答案:  (2)CaO+H2O=Ca(OH)2 (3)Ca(OH)+Na2CO3=CaCO3↓+2NaOH
(2)CaO+H2O=Ca(OH)2 (3)Ca(OH)+Na2CO3=CaCO3↓+2NaOH
查看答案和解析>>
科目: 来源: 题型:
分析:仅用一种试剂鉴别五种物质的溶液,符合这一要求的试剂,应该在分别与五种溶液反应时各出现不同的现象。因此,可将选项中的试剂与五种物质分别反应,能够分别产生不同现象的,就是所选试剂。H2SO4与HCl、FeCl3、MgCl2、酚酞均不反应,因此,排除选项B。AgNO3与HCl、FeCl3、MgCl2反应,均出现白色沉淀,与CuSO4反应也出现白色浑浊,由此可知选项C也不符合题意。
NaOH与HCl发生中和反应,但无明显现象;NaOH与CuSO4反应会产生Cu(OH)2的蓝色沉淀,与FeCl3反应会产生Fe(OH)3的红褐色沉淀,与MgCl2反应会生成Mg(OH)2的白色沉淀;NaOH可使酚酞试液变成红色。用NaOH溶液可将五种溶液鉴别开。
Ba(OH)2与HCl反应无明显现象,与CuSO4反应产生BaSO4白色沉淀和Cu(OH)2蓝色沉淀,与FeCl3反应产生Fe(OH)3的红褐色沉淀,与MgCl2反应产生Mg(OH)2白色沉淀,也可使酚酞试液变成红色。因此,Ba(OH)2也可将五种溶液鉴别开。答案:A、D
查看答案和解析>>
科目: 来源: 题型:
分析:H2SO4和BaCl2反应生成BaSO4和HCl,再用NaOH中和剩余H2SO4时,不能忽视NaOH又和生成HCl发生反应的这个隐蔽反应,而且这个反应是解题时不走弯路的关键。
【常规解法】(l)设BaCl2消耗H2SO4的质量为x,反应生成HCl的质量为y
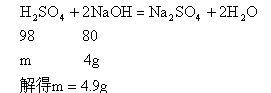 (2)设HCl消耗NaOH的质量为z
(2)设HCl消耗NaOH的质量为z
在反应中共消耗NaOH质量为32g×25%=8g,中和HCl用去4g,尚余4g
 (3)设4gNaOH中和的H2SO4质量为m
(3)设4gNaOH中和的H2SO4质量为m
硫酸中溶质的质量分数为
 答案:(略)
答案:(略)
【解法二】此题稍加分析,即可一步解出:用BaCl2的量不能求出H2SO4的量是因BaCl2不足量,而用NaOH的量却可求出H2SO4的量,因二者是完全中和的反应。之所以可用NaOH 而H+并未参加反应,而H+却恰好被NaOH中和完全,所以可据与NaOH的中和反应求H2SO4的量。
而H+并未参加反应,而H+却恰好被NaOH中和完全,所以可据与NaOH的中和反应求H2SO4的量。
设:H2SO4的量为x

硫酸中溶质的质量分数为 答案:(略)
答案:(略)
查看答案和解析>>
科目: 来源: 题型:
分析:从表面看氧化钠似乎是溶质,其实它具有与水化合的性质,因此这里就隐蔽着氧化钠和水化合生成氢氧化钠的反应。可见真正溶质是氢氧化钠,其质量要通过计算才能得出。
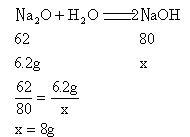 【解】设生成NaOH的质量为x
【解】设生成NaOH的质量为x
所得溶液中NaOH的质量分数为
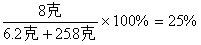 答案:(略)
答案:(略)
查看答案和解析>>
科目: 来源: 题型:
答案:(1)粉刷墙壁用的石灰浆,其主要成份氢氧化钙,住人后,由于人的呼吸作用,使房间内的二氧化碳含量比没住人前增加,二氧化碳跟氢氧化钙反应生成碳酸钙和水。因此,墙壁变得坚硬、潮湿。住一段时间后,水份蒸发,潮湿现象消失。
(2)制烧碱的原料是生石灰、水和碳酸钠,反应的化学方程式如下:
CaO+H2O=Ca(OH)2 Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
(3)能使酚酞变红的溶液显碱性,但溶质不一定是碱。某些物质溶于水后,也能使溶液显碱性,如Na2CO3、K2CO3等,它们不是碱而是盐。所以不能说“使酚酞变红的溶液一定是碱溶液。”
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com