
科目: 来源: 题型:
分析:一般条件下,铁、铝、铜、锌与稀硫酸反应如下:
Fe+H2SO4(稀)= FeSO4+H2↑ 2Al+3H2SO4(稀)= Al2(SO4)3+3H2↑
Cu+H2SO4(稀)≠ Zn+H2SO4(稀)=ZnSO4+H2↑
由上述反应可知,应选AC。答案:AC
查看答案和解析>>
科目: 来源: 题型:
分析:天平平衡问题的计算一般指反应前天平已处于平衡,向托盘两边烧杯中加入物质后,引起烧杯内物质净增的变化量,从而确定天平能否再处于平衡。烧杯内物质净增质量=加入物质质量-放出气体质量,当左边净增质量=右边净增质量时,天平处于平衡;当左边净增质量>右边净增质量,天平指针会向左边偏转。
(1)当m1=m2=a时,要判断天平指是否偏转,关键要判断两边放出气体的质量是否相等。
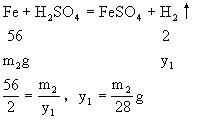
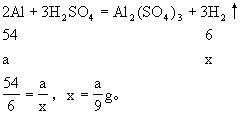 设ag铝片生成氢气质量为x,ag铁片生成氢气质量为y。
设ag铝片生成氢气质量为x,ag铁片生成氢气质量为y。

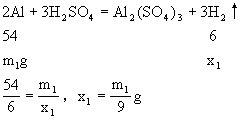 乙烧杯中物质的质量大,指针偏向乙烧杯。
乙烧杯中物质的质量大,指针偏向乙烧杯。
(2)若要指针不偏转,则要求甲、乙两烧杯中物质净增质量相等。设m1 g铝片生成氢气质量为x1,m1 g铁片生成氢气质量为y1。
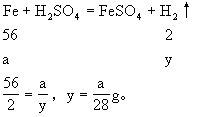
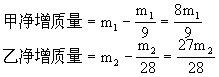
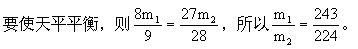 答:(1)偏乙;等质量的Al和Fe比较,Al反应产生的H2多些。 (2)243:224。
答:(1)偏乙;等质量的Al和Fe比较,Al反应产生的H2多些。 (2)243:224。
查看答案和解析>>
科目: 来源: 题型:
分析:首先搞清:①石灰石的主要成分是CaCO3;②混合物减少的质量即CaCO3跟盐酸反应,生成CO2的质量;③根据化学方程式中CaCO3与盐酸、CO2的质量关系可计算出CaCO3的质量和用去盐酸的质量,再根据密度即可求出盐酸的体积。
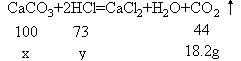 解:设参加反应的CaCO3的质量为xg,盐酸溶液中的溶质质量为y。
解:设参加反应的CaCO3的质量为xg,盐酸溶液中的溶质质量为y。
100∶44=x∶18.2g x=41.4g
 73∶44 = y∶18.2g y=30.2g
73∶44 = y∶18.2g y=30.2g
消耗盐酸=30.2g÷20%=151g
20%盐酸的体积=151/1.10=137.3(mL)答:略。
查看答案和解析>>
科目: 来源: 题型:
分析:1.本题要选择适当的试剂除去氯化氢,适当的干燥剂除去水蒸气。除去氯化氢的试剂要求不能大量消耗主要成分二氧化碳气和不能引入新的杂质。根据二氧化碳和盐酸(氯化氢溶于水形成盐酸)的化学性质,选择饱和碳酸氢钠溶液作为试剂,它能跟盐酸反应生成二氧化碳,使氯化氢气转化为二氧化碳而除去。NaHCO3+HCl=NaCl+CO2↑+H2O
2.除去水蒸气应选择不与CO2反应的干燥剂。由于浓硫酸有吸水性,可选用浓硫酸作干燥剂。
3.应该先用浓硫酸除水蒸气?还是先用碳酸氢钠溶液除去氯化氢呢?当混有杂质的气体通过碳酸氢钠溶液里,除去了其中的氯化氢气,导出的气体一定又混入了水蒸气。所以,为了获得既纯净又干燥的气体,应使混合气先通过饱和碳酸氢钠溶液,后通过浓硫酸。
答案:方法示意如下。
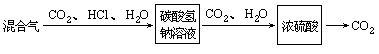
查看答案和解析>>
科目: 来源: 题型:
分析:1.检验Cl-应选AgNO3溶液作试剂,检验 应选BaCl2溶液作试剂。鉴别稀盐酸(含Cl-)和稀硫酸(含量
应选BaCl2溶液作试剂。鉴别稀盐酸(含Cl-)和稀硫酸(含量 )应选择AgNO3溶液作试剂?还是BaCl2溶液作试剂呢?
)应选择AgNO3溶液作试剂?还是BaCl2溶液作试剂呢?
如用AgNO3溶液作试剂,则与盐酸反应生成AgCl白色沉淀,与稀硫酸接触可能生成Ag2SO4白色沉淀,也可能没有明显现象,这与Ag2SO4的微溶性有关,如果稀硫酸较浓,与AgNO3溶液反应生成Ag2SO4的量超过了它的溶解度,则生成沉淀,使得稀盐酸和稀硫酸现象相似而无法区别出来。所以应选择BaCl2溶液作试剂,BaCl2溶液接触稀硫酸,生成BaSO4白色沉淀,接触到盐酸,没有明显变化现象而使两者鉴别出来。
2.实验操作时,要分别取少量在试管中(记录下取自哪瓶溶液),再分别加入几滴BaCl2溶液,从观察是否生成白色沉淀来鉴别。千万别把BaCl2溶液滴入试剂瓶中,这样既使鉴别出来它们,同时也污染了待测溶液。
3.鉴别这两种酸,除加BaCl2试剂外,是否还需加入HNO3(或HCl)溶液?
鉴别是把两种物质(或两种以上)区分开,无需把物质中的离子都加以确认,只要通过物质的特殊性把它们分辨出来即可。鉴定则要求将物质的成分通过化学方法确定下来。要鉴定稀硫酸的 ,除加入特征试剂BaCl2外,还需加入排除干扰试剂稀HNO3(或HCl)。本题不属于鉴定范畴,不需加入HNO3(或HCl)溶液。 答案:见分析。
,除加入特征试剂BaCl2外,还需加入排除干扰试剂稀HNO3(或HCl)。本题不属于鉴定范畴,不需加入HNO3(或HCl)溶液。 答案:见分析。
查看答案和解析>>
科目: 来源: 题型:
分析:解决此题时,要抓住特征现象。根据产生无色气体的C、D一定是Na2CO3和HCl。其中Na2CO3还能与BaCl2产生白色沉淀,又知B+C能产生白色沉淀,由此得出C必为Na2CO3,D为HCl。B为BaCl2、A为Na2SO4而得出结论。
检验:A+C是Na2SO4与Na2CO3而无变化。A+D是Na2SO4与HCl而无变化。B+D是BaCl2与HCl而无变化。答案: A为Na2SO4 ,B为BaCl2 ,C为Na2CO3 ,D为HCl
查看答案和解析>>
科目: 来源: 题型:
分析:盐酸的特性是易挥发,敝口放置,浓盐酸中的溶质──氯化氢会挥发,使溶液的质量减少;浓硫酸易吸收空气的水分(吸水性)而使溶液的质量增加,使天平不能保持平衡。
答案:天平将不平衡,天平指针将向盛浓硫酸一方倾斜。因浓盐酸有挥发性,使溶液质量减小,放置浓硫酸一边用浓硫酸有吸水性,而使溶液质量增加,使天平指针向盛浓硫酸一方倾斜。
查看答案和解析>>
科目: 来源: 题型:
分析:提纯必须是除去杂质的同时,不能带入新的杂质,上述四种物质均与原物反应:
A.AgNO3+HCl=AgCl↓+HNO3
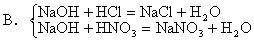
C.盐酸与Cu不反应,硝酸与铜反应,生成Cu(NO3)2、HNO3与Zn还产生Zn(NO3)2
D.Zn+2HCl=ZnCl2+H2↑由上可知,只有A可选。答案:A
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com