
科目: 来源: 题型:
氯碱工业是重要的化学工业,采用电解精制的饱和食盐水来制取NaOH,
 2NaCl + 2H2O 2NaOH + H2↑ + Cl2↑。但粗盐中含有杂质Na2SO4、MgCl2、CaCl2
2NaCl + 2H2O 2NaOH + H2↑ + Cl2↑。但粗盐中含有杂质Na2SO4、MgCl2、CaCl2
、泥沙等,必须经过提纯才能使用。提纯中常用下列操作步骤:①用稍过量的NaOH除去MgCl2;②过滤;③用稍过量的BaCl2除去Na2SO4;④用稍过量的Na2CO3除去CaCl2等;⑤用稍过量的HCl除去NaOH、Na2CO3;
则:(1)正确的操作顺序为 或 (填步骤编号);
(2)加入Na2CO3溶液,其目的之一是除去CaCl2,还的一个目的,其反应的化学方程式为 。
查看答案和解析>>
科目: 来源: 题型:阅读理解
通过晾晒海水或煮盐井水、盐湖水等,可以蒸发除去水分得到粗盐。粗盐中含有难溶性杂质(泥沙等)和多种可溶性杂质(氯化镁、氯化钙等)。
[提出问题]如何才能将粗盐中难溶性杂质和可溶性杂质(氯化镁、氯化钙)除去,从而获得较纯的食盐晶体?
[资料准备]
| 20℃时,一些物质的溶解度 | ||
| OH- | CO32- | |
| Na+ | 溶 | 溶 |
| Ca2+ | 微 | 不 |
| Mg2+ | 不 | 微 |
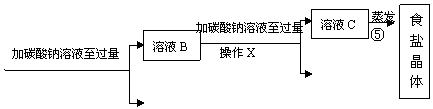
[实验方案]某同学为了提纯粗盐,设计了如下实验方案并进行实验。
 | |||
| |||
|
|
|
|


|

|
 | |||||||
| |||||||
| |||||||
| |||||||
[交流与表达]
(1)实验步骤①和②的目的是 ;实验步骤③和④的目的是 。
(2)实验操作X的名称是 ,该操作中要用到的玻璃仪器有烧杯、玻璃棒和 。
(3)实验步骤③的主要目的是 (用化学方程式回答);判断氢氧化钠溶液已过量的方法是 。
(4)实验步骤④中生成的沉淀D是 。
(5)实验步骤⑤用蒸发溶剂的方法而不用降低溶液温度的方法获取食盐晶体,原因是
;在蒸发食盐溶液的过程中要使用玻璃棒,作用是 。
[反思与评价]
(6)有同学认为只需要用氢氧化钠溶液和碳酸钠溶液中任意一种试剂就能将两种可溶性杂质出去,你认为这种方法 (选填“可行”或“不可行”),理由是
。
(7)有同学认为原实验方案不完善,做出这种评价的依据是 。
[实验方案设计]
(8)为了完善原实验发难,你设计的实验是
(仅写出补充部分的实验操作和现象)
查看答案和解析>>
科目: 来源: 题型:
(1)大佛上游的岷江,在枯水期的一段时间,江面上出现大面积的绿色浮萍。你认为导致这一现象最可能的原因是(填编号) 。
A.为实现“绿色化学”、改善景观而人工种植的绿色植物
B.上游某化工厂向江中排放了含大量Fe3+、Cu2+、OH—的废水
C.含较多氮、磷的生产生活污水直接排放到江中,导致藻类疯长
(2)长期饮用硬水易引起结石病。为检测大佛附近的居民饮用水是否是硬水,可向所取水样及另一软水中加入等量的肥皂水,振荡,根据产生 的多少来判断。将硬水煮沸可以得到软水和水垢,水垢的主要成分是CaCO3和Mg(OH)2,从水垢中提取氯化钙的主要流程如下:
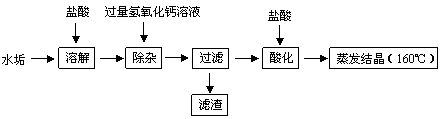 |
a.滤渣的主要成分是 (填化学式)。
b.加盐酸酸化,其目的之一是除去未反应的氢氧化钙,写出反应的化学方程式 。
查看答案和解析>>
科目: 来源: 题型:
用海水制得的粗盐中含有多种可溶性杂质(氯化镁、氯化钙等)和不溶性杂质(泥沙等)。请回答下列问题:
(1)实验室去除粗盐中难溶性杂质的一般步骤是:溶解、过滤、 、计算产率;
(2)若要去除粗盐中可溶性的杂质氯化镁和氯化钙,可以依次加入过量的氢氧化钠和碳酸钠两种溶液,写出其中的一个化学方程式 ,过滤后向滤液中加入过量的盐酸,其目的是 ,最后通过蒸发结晶得到较为纯净的氯化钠。
查看答案和解析>>
科目: 来源: 题型:
海水是巨大的资源宝库。如图所示利用海水为原料可获得许多化工产品:
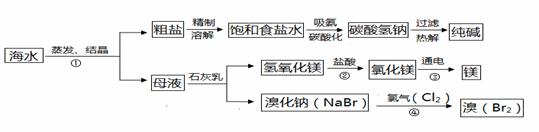
(1)要鉴别海水是硬水还是软水,可选用的试剂是 。
(2)步骤①中选用蒸发结晶法而不用降温结晶法的理由是 。
(3)制纯碱过程中,其中过滤操作所需要的玻璃仪器有烧杯、漏斗和 。
(4)步骤②发生反应的化学方程式是 ,其基本反应类型为 。用镁制造的一种镁铝合金常用作生产飞机外壳的材料,该材料具有的优良性能有 (任答一点)。
(5)步骤④发生的反应为置换反应(类似于金属与盐溶液之间的反应),试写出该反应的化学方程式 ;此反应能够发生是因为 。
查看答案和解析>>
科目: 来源: 题型:
某化学兴趣小组的同学做粗盐(含有难溶性杂质)提纯实验,并用所得的精盐配制50 g 5%的氯化钠溶液。
实验一:图10是同学们做粗盐提纯实验的操作示意图。
 |
请回答下列问题:
(1)操作③中用玻璃棒搅拌的作用是 。
(2)操作⑥中的错误是 。
(3)粗盐提纯实验的操作顺序为(填操作序号) 、称量精盐并计算产率。
(4)操作④中,当观察到 时,停止加热。
实验二:用提纯得到的精盐配制了50 g 5%的氯化钠溶液。经检测,溶质质量分数偏小,其原因可能有 (填序号)。
①氯化钠固体仍然不纯 ②称量时砝码端忘垫质量相同的纸片
③量取水时,仰视读数 ④装瓶时,有少量溶液洒出
查看答案和解析>>
科目: 来源: 题型:
如图是甲、乙两种固体物质的溶解度曲线.
(1)由图中可看出,甲乙两物质中,溶解度受温度影响较大的物质是 ;
(2)要使甲的饱和溶液变为不饱和溶液,可采取的方法是 (写出一种即可);
(3)t2℃时,将甲、乙各20g分别加入到两只盛有100g水的烧杯中,充分搅拌,所得乙溶液为 溶液(填“饱和”或“不饱和”);若将温度都降低到t1℃,甲溶液中溶质的质量分数 (填“>”、“<”或“=”)乙溶液中溶质的质量分数.

查看答案和解析>>
科目: 来源: 题型:
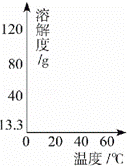
下表是KNO3的部分溶解度数据,请回答问题:
(1)40℃时,将70gKNO3固体加入100g水中,充分搅拌,形成的溶液质量为 g.
(2)60℃时,KNO3的饱和溶液中得到晶体的一种方法是 .
(3)依据表中数据,请在如图坐标图中画出KNO3溶解度曲线的草图.
| 温度/℃ | 0 | 20 | 40 | 60 |
| 溶解度/g | 13.3 | 31.6 | 63.9 | 110 |
查看答案和解析>>
科目: 来源: 题型:
20℃时,将等质量的甲、乙两种固体物质,分别加入到盛有100g水的烧杯中,充分搅拌后现象如图1,加热到50℃时现象如图2,甲、乙两种物质的溶解度曲线如图3.请结合图示回答下列问题:
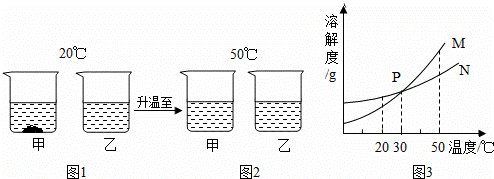
(1)图1中一定为饱和溶液的是 .
(2)图2中甲、乙两溶液中溶质质量分数的大小关系为 .
(3)图3中表示乙的溶解度曲线是 ;P点表示的含义是 .
查看答案和解析>>
科目: 来源: 题型:
下表是KNO3 、NaCl在不同温度下的溶解度(单位:g/100g水)
| 温度(℃) | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| KNO3 | 13.3 | 20.9 | 32 | 45.8 | 64 | 85.5 | 110 | 138 | 169 | 202 | 246 |
| NaCl | 35.7 | 35.8 | 36 | 36.3 | 36.6 | 37 | 37.3 | 37.8 | 38.4 | 39 | 39.8 |
①以上两种物质溶解度的变化受温度影响较小的是 。
②30℃时,KNO3 的溶解度是 g/100g水。
③KNO3 溶液中含有少量NaCl时,可通过 的方法提纯。
④对③析出的晶体和剩余溶液描述正确的是 (填写编号)。
Ⅰ.剩余溶液一定是KNO3饱和溶液 Ⅱ.剩余溶液一定是NaCl
Ⅲ.上述方法可以将两者完全分离 Ⅳ.析出的晶体中只含有KNO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com