
科目: 来源: 题型:阅读理解
能源问题是人类社会面临的重大课题,甲醇是一种可再生能源,具有开发和应用的广阔前景,研究
甲醇具有重要意义。
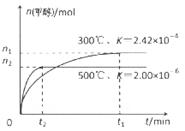 (1)用CO合成甲醇的反应为:CO(g)+2H2(g)
(1)用CO合成甲醇的反应为:CO(g)+2H2(g)  CH3OH (g)
CH3OH (g)
在容积为1L。的密闭容器中分别充入1molCO和2molH2,实验 测得甲醇的物质的量和温度、时间的关系曲线如右图所示。则该正反应的△H_______0(填“<”、“>”或“=”),判断的理由是______。
(2)利用工业废气中的CO2可制取甲醇,其反应为:CO2+3H2 CH3OH+H2O。
CH3OH+H2O。
①常温常压下已知下列反应的能量变化如下图所示:

由二氧化碳和氢气制备甲醇的热化学方程式为_______。
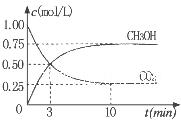 ②为探究用CO2生产燃料甲醇的反应原理,现进行如下实验:在一恒温恒容密闭容器中,充入1molCO2 和3molH2,进行上述反应。测得CO2。
②为探究用CO2生产燃料甲醇的反应原理,现进行如下实验:在一恒温恒容密闭容器中,充入1molCO2 和3molH2,进行上述反应。测得CO2。
和CH3OH(g)的浓度随时间变化如右图所示。从反应开始到
平衡,v(H2)=_______ ;该温度下的平衡常数数值K=______。
能使平衡体系中n(CH3OH)/n(CO2))增大的措施有_______(任写一条)。
(3)工业上利用甲醇制备氢气的常用方法有两种。
 ①甲醇蒸汽重整法。主要反应为;CH3OH(g)
①甲醇蒸汽重整法。主要反应为;CH3OH(g)  CO(g)+2H2(g)设在容积为2.0L的密闭容器中充入0. 60 molCH3OH(g),体系压强为P1,在一定条件下达到平衡时,体系压强为P2,且P2/P1 =2.2,则该条件下CH3OH 的平衡转化率为______ 。
CO(g)+2H2(g)设在容积为2.0L的密闭容器中充入0. 60 molCH3OH(g),体系压强为P1,在一定条件下达到平衡时,体系压强为P2,且P2/P1 =2.2,则该条件下CH3OH 的平衡转化率为______ 。
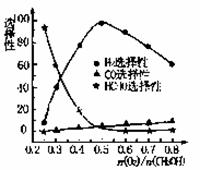
②甲醇部分氧化法。在一定温度下以Ag/CeO2-ZnO为催
化剂时原料气比例对反应的选择性(选择性越大,表示生成的该物质越多)影响关系如右图所示。则当n(O2)/n(CH3OH) =0.25时。CH3OH与O2发生的主要反应方程式为______ 。在制备H2:时最好控制n(O2))/n(CH3OH)=______。
查看答案和解析>>
科目: 来源: 题型:
有关下图及实验的描述正确的是

A.用甲图装置电解精炼铝
B.用乙图装置制备
C.丙图装置可制得金属锰,用同样的装置可制得金属铬
D.丁图验证NaHCO3和Na2CO3热稳定性
查看答案和解析>>
科目: 来源: 题型:
有Al、CuO、Fe2O3组成的混合物共10.0 g,放入500 mL某浓度的盐酸溶液中,混合物完全溶解,当再加入250 mL 2.0 mol/L的NaOH溶液时,得到的沉淀最多。上述盐酸溶液的浓度为( )
A.0.5 mol/L B.3.0 mol/L
C.2.0 mol/L D.1.0 mol/L
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是( )
A.原子最外层电子数为2的元素一定处于周期表的第IIA族
B.构成单质的分子中一定含有共价键
C.同主族元素形成的氧化物的晶体类型均相同
D.金属与非金属元素形成的化合物可能是离子化合物
查看答案和解析>>
科目: 来源: 题型:
相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:
2NH3(g) N2(g)+3H2(g) △H=+92.4kJ/mol
N2(g)+3H2(g) △H=+92.4kJ/mol
实验测的起始、平衡时的有关数据如下表:
| 容器编号 | 起始时各物质物质的量/mol | 平衡时反应中的能量变化 | ||
| NH3 | N2 | H2 | ||
| ① | 2 | 0 | 0 | 吸收热量akJ |
| ② | 0 | 1 | 3 | 放出热量bkJ |
| ③ | 4 | 0 | 0 | 吸收热量ckJ |
下列叙述正确的是
A.热量关系:a=b
B.反应的平衡常数:③>①>②
C.达平衡时H2的体积分数:①>③
D.①中的密度不再改变时说明反应已达到平衡状态
查看答案和解析>>
科目: 来源: 题型:
利用实验器材(规格和数量不限),能完成相应实验的一项是( )
| 实验器材(省略夹持装置) | 相应实验 | |
| A | 烧杯、玻璃棒、蒸发皿 | 硫酸铜溶液的浓缩结晶 |
| B | 烧杯、玻璃棒、胶头滴管、滤纸 | 用盐酸除去硫酸钡中的少量碳酸钡 |
| C | 烧杯、玻璃棒、胶头滴管、容量瓶 | 用固体氯化钠配制0.5mol/L的溶液 |
| D | 烧杯、玻璃棒、胶头滴管、分液漏斗 | 用溴水和CCl4除去NaBr溶液中的少量NaI |
查看答案和解析>>
科目: 来源: 题型:
常温下,Na2CO3溶液中有平衡: 则下列说法正确的是( )
则下列说法正确的是( )
A.Na2CO3溶液中:c(Na+) > c(CO32-) > c(OH-) > c(H+) B.加入NaOH固体,溶液pH减小
C.Na2CO3溶液中:c(Na+) +c(H+) =2c(CO32-) +c(OH-) D.升高温度平衡向正反应方向移动
查看答案和解析>>
科目: 来源: 题型:
2013年12月初,我国华北地区持续出现严重雾霾天气,严重影响人们的生活。为让生态环境得到有效保护,下列做法均正确的是( )
①尽量减少化石燃料的使用 ②全面关停化工企业 ③研发易降解的生物农药
④改进汽车尾气净化技术
A.①②③ B.①③④ C.①②④ D.②③④
查看答案和解析>>
科目: 来源: 题型:
(本题共12分)
已知:
| 药品名称 | 熔点/℃ | 沸点(℃) | 密度g/cm3 | 溶解性 |
| 正丁醇 | -89.5 | 117.7 | 0.8098 | 微溶于水、溶于浓硫酸 |
| 1-溴丁烷 | -112.4 | 101.6 | 1.2760 | 不溶于水和浓硫酸 |
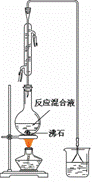 根据题意完成下列填空:
根据题意完成下列填空:
(一)制备1-溴丁烷粗产品
在右图装置的圆底烧瓶中依次加入NaBr,10 mL正丁醇,2粒沸石,分批加入1:1的硫酸溶液,摇匀,加热30 min。
(1)写出制备1-溴丁烷的化学反应方程式:
__________________________________________________
(2)反应装置中加入沸石的目的是__________________。
配制体积比为1:1的硫酸所用的定量仪器为 (选填编号)。
a.天平 b.量筒 c.容量瓶 d.滴定管
(3)反应装置中,除了产物和水之外,还可能存在 、 等有机副产物。
(4)若用浓硫酸进行实验,有机层中会呈现棕黄色,除去其中杂质的正确方法是 (选填编号)。
a.蒸馏 b.氢氧化钠溶液洗涤
c.用四氯化碳萃取 d.用亚硫酸钠溶液洗涤
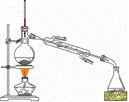 (二)制备精品
(二)制备精品
将得到的粗1-溴丁烷依次用浓硫酸、水、10% 碳酸钠、水洗涤后加入无水氯化钙进行干燥,然后再将1-溴丁烷按右图装置蒸馏。
(5)收集产品时,控制的温度应在_________℃左右;
区分1-溴丁烷精品和粗品的一种方法是____________________。
(6)实验制得的1-溴丁烷的质量为10.895 g,则正丁醇的转化率为 。(保留3位小数)。
查看答案和解析>>
科目: 来源: 题型:
【化学—选修5:有机化学基础】(15分)I.施安卡因(G)是一种抗心律失常药物,可由下列路线合成。
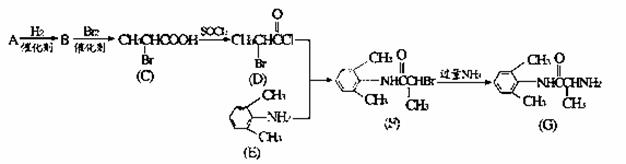
(1)已知A是 的单体,则A中所含官能团的名称是______ 。
的单体,则A中所含官能团的名称是______ 。
(2)B的结构简式为______;用系统命名法给C命各为______。
(3)C与足量NaOH醇溶液共热时反应的化学方程式为______。F→G的反应类型为______。
(4)L是E的同分异构体,分子中含有苯环且苯环上一氯代物只有两种,则L所有可能的结构简式有 、_______、_______、_______。
、_______、_______、_______。
Ⅱ.H是C的同系物,其核磁共振氢谱有两个峰。按如下路线,由H可合成高聚物V

(5)H的结构简式为______。
(6)Q→V反应的化学方程式______.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com