
科目: 来源:2013-2014学年广西省业考试模拟考试化学试卷(解析版) 题型:选择题
电影《黄金大劫案》上映后,里面用“王水”(浓盐酸与浓硝酸的混合液)溶解黄金的情引起了广泛的热议。黄金溶解在“王水”中形成HAuCl4(四氯合金酸),没有氢气产生。根据以上信息,下列有关说法正确的是①“王水”溶解黄金是化学变化;②金比氢活泼;③HAuCl4中,Au的化合价为+3价;④可以将pH试纸伸入“王水”中测其酸碱度;⑤“王水”可以用铁质容器盛装。
A.①④⑤ B.①③ C.③④⑤ D.①②③
查看答案和解析>>
科目: 来源:2013-2014学年广西省业考试模拟考试化学试卷(解析版) 题型:选择题
某同学在实验室配制50g 6%的氯化钠溶液,下图所示的部分操作其中错误的是

A.取一定量的NaCl B.称取3gNaCl C.量取47mL水 D.溶解
查看答案和解析>>
科目: 来源:2013-2014学年广西省业考试模拟考试化学试卷(解析版) 题型:选择题
硝酸钾和氯化钠的溶解度曲线如图所示。30℃时,分别将30g硝酸钾和氯化钠放入100 g水中,充分溶解。下列结论中,不正确的是( )

A.两种溶液中溶质的质量分数相等
B.通常情况下,降温能将两种溶液都变成饱和溶液
C.若将硝酸钾溶液降温到20℃, 溶液中溶质和溶剂的质量比为3:10
D.若将硝酸钾溶液变为10℃时的饱和溶液, 溶液中溶质的质量分数一定减小
查看答案和解析>>
科目: 来源:2013-2014学年广西省业考试模拟考试化学试卷(解析版) 题型:选择题
除去下列物质中的少量杂质,所选试剂及操作都正确的是
序号 物质 杂质 试剂 操作
A FeCl2溶液 CuCl2 过量铁粉 结晶
B CO2 H2O 浓硫酸 洗气
C NaNO3溶液 Na2CO3 适量CaCl2溶液 过滤
D 铜粉 铁粉 过量水 过滤
查看答案和解析>>
科目: 来源:2013-2014学年广西省业考试模拟考试化学试卷(解析版) 题型:选择题
如下图所示,装置气密性良好,弹簧夹处于关闭状态。挤压胶头滴管加入液体,一段时间后,打开弹簧夹,能是气球a明显鼓起的是

试管内物质[来 胶头滴管内物质
A 氢氧化钠固体 水
B 氧化铁 稀盐酸
C 氯化钡溶液 稀硫酸
D 二氧化碳 氢氧化钠溶液
查看答案和解析>>
科目: 来源:2013-2014学年广西省业考试模拟考试化学试卷(解析版) 题型:推断题
我国化学家侯德榜创立了著名的“侯氏制碱法”(流程简图如图),反应原理为NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3(析出),促进了世界制碱技术的发展.下列说法正确的是

A.沉淀池中的反应物共含有4种元素
B.过滤得到的“母液”中一定只含有两种溶质
C.图中X可能是氨气
D.通入氨气的作用是使溶液呈碱性,促进二氧化碳的吸收,更多地析出沉淀
查看答案和解析>>
科目: 来源:2013-2014学年广西省业考试模拟考试化学试卷(解析版) 题型:填空题
碳元素是组成物质的基本元素,“碳循环”也是自然界重要的循环,根据所学完成下题:
(1)碳元素形成的单质除金刚石、石墨外,还有一种物质的分子类似足球状,这种物质的化学式为________,它们都属于__ ____(选填“有机物”、“无机物”或“单质”)
(2)化石燃料主要包括煤、石油 和天然气,都含有碳元素,其中天然气的主要成分是 (写化学式),其完全燃烧的化学方程式是
(3)CO2常用于灭火,但镁着火不能用 CO2灭火,原因是它们能发生反应,请写出该置换反应的化学方程式 _____
(4)矿石中含碳元素,菱锰矿的成分是碳酸锰( MnCO3),其中锰元素的化合价 。
(5)在 440℃和高压条件下,金属钠与二氧化碳反应能生成金刚石(C)和碳酸钠,该反应的化学方程式为 。
查看答案和解析>>
科目: 来源:2013-2014学年广西省业考试模拟考试化学试卷(解析版) 题型:填空题
从2013年开始,学生实验操作成绩计入中考,某校进行实验考查,给出以下三个考题:
①粗盐提纯;②二氧化碳的制取;③氧气的制取。考查规定由学生抽签确定考题。

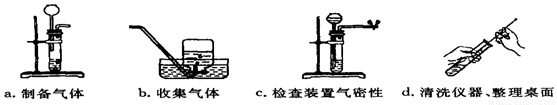
Ⅰ.甲同学抽签后被监考老师引导至准备了上图仪器和药品的实验台前:
(1)上图中仪器A的名称是 ;甲同学抽到的考题是 ("填序号);实验前甲同学发现其中缺少了一种药品,该药品是 ;写出该实验反应的化学方程式
(2)下图是甲同学实验时的主要步骤,这些步骤的正确顺序是 (填字母标号),其中装置有误的是 (填字母标号),改正的方法是 。
(3)当观察到 现象时,甲同学可以开始b操作。
(4)若另选药品,也能完成另一个考题的气体制备,其反应化学方程式表示为 。
Ⅱ.乙同学抽签后,监考老师告诉他:食盐样品中含有少量沙土、氯化钙和氯化镁。乙同学思考后按以下流程除去食盐样品中沙土、氯化钙和氯化镁:

请根据流程图回答:
(1)操作Ⅰ的名称是 ;加入的试剂A是
(2)写出NaOH与杂质反应的化学方程式 ;
(3)蒸发结晶时用到玻璃棒的作用是 。
查看答案和解析>>
科目: 来源:2013-2014学年广西省业考试模拟考试化学试卷(解析版) 题型:填空题
人类的生产生活离不开金属材料,随着科技水平的不断提高,金属及其合金在日常生活中扮演着越来越重要的角色。
(1)人们习惯上把金、银、铜、铁、锡五种金属统称为“五金”,在“五金”顺序中把金属 的位置移到最后,正好符合由弱到强的顺序.
(2)汽车车体多用钢材制造。表面喷漆不仅美观,而且可有效防止与 接触而生锈。
(3)工业上用CO还原赤铁矿冶炼金属铁的化学方程为 。
西汉时期中国古老的冶铜方法是“湿法冶铜”主要的反应原理是铁与硫酸铜溶液反应,写出反应的化学方程式
(4)在实验室中探究铝、铜的金属活动性顺序,除铝、铜外,还需要用到的试剂是 。(填一种即可)
(5)铁锅、铝锅是生活中常用的炊具,下图是铁锅的示意图。

①铁锅含有合金单质_______(写化学式),含有的有机合 成材料是_________。(填写名称)
②炒菜时铁锅中的油着火可用锅盖盖灭,其原理是______________________________________。
③铜也易生锈,铜锈的主要成分是碱式碳酸铜(Cu2(OH)2CO3),是铜与空气中的氧气、水和 共同作用的结果.
查看答案和解析>>
科目: 来源:2013-2014学年广西省业考试模拟考试化学试卷(解析版) 题型:填空题
科学家设想利用太阳能加热器“捕捉CO2”、“释放CO2”,实现碳循环.

(1)步骤1的化学方程式为 .
(2)为确定步骤2中的碳酸钙是否完全分解,设计的实验步骤为:取少量固体于试管中,滴加过量 溶液,若观察到试管内 .则分解不完全.
(3)上述设想的优点有 (填字母序号).
A.原料易得且可循环利用 B.充分利用太阳能 C.可全地域全天候使用
(4)CO2是宝贵的碳氧资源.CO2和H2在一定条件下可合成甲酸(HCOOH),此反应中CO2与H2的分子个数比为 ,若要检验1%甲酸水溶液是否显酸性,能选用的有 (填字母序号).
A.无色酚酞溶液 B.紫色石蕊溶液 C.PH试纸
(5)请列举CO2的另一种用途 它含量过高还容易引起的环境问题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com