
科目: 来源:2013年第二十三届“天原杯”全国初中学生化学素质和实验能力竞赛复赛试卷(解析版) 题型:填空题


查看答案和解析>>
科目: 来源:2013年第二十三届“天原杯”全国初中学生化学素质和实验能力竞赛复赛试卷(解析版) 题型:填空题
| 1H +1 | 2He | ||||||
| 3Li +1 | 4Be +2 | 5B +3 | 6C +4 -4 | 7N +5 -3 | 8O -2 | 9F -1 | 10Ne |
| 11Na +1 | 12Mg +2 | 13Al +3 | 14Si +4 -4 | 15P +5 -3 | 16S | 17Cl +7 -1 | 18Ar |
查看答案和解析>>
科目: 来源:2013年第二十三届“天原杯”全国初中学生化学素质和实验能力竞赛复赛试卷(解析版) 题型:填空题
| 中和试剂 | 氢氧化钠 | 氢氧化钙 |
| 价格/ | 800 | 450 |
查看答案和解析>>
科目: 来源:2013年第二十三届“天原杯”全国初中学生化学素质和实验能力竞赛复赛试卷(解析版) 题型:填空题
查看答案和解析>>
科目: 来源:2013年第二十三届“天原杯”全国初中学生化学素质和实验能力竞赛复赛试卷(解析版) 题型:填空题
查看答案和解析>>
科目: 来源:2013年第二十三届“天原杯”全国初中学生化学素质和实验能力竞赛复赛试卷(解析版) 题型:填空题
| 实验编号 | 实验目的 | 温度/℃ | pH | 浓度/ | |
| H2O2 | Fe2+ | ||||
| ① | 为②③提供参照 | 25 | 3 | 204 | 16.8 |
| ② | 探究温度对降解反应速率的影响 | ||||
| ③ | 25 | 10 | 204 | 16.8 | |
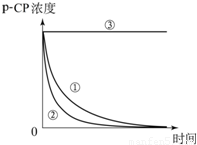
查看答案和解析>>
科目: 来源:2013年第二十三届“天原杯”全国初中学生化学素质和实验能力竞赛复赛试卷(解析版) 题型:填空题
| 海水密度/ | CaSO4 | NaCl | MgCl2 | MgSO4 | NaBr |
| 1.13 | 0.56 | ||||
| 1.20 | 0.91 | ||||
| 1.21 | 0.05 | 3.26 | 0.004 | 0.008 | |
| 1.22 | 0.015 | 9.65 | 0.01 | 0.04 | |
| 1.26 | 0.01 | 2.64 | 0.02 | 0.02 | 0.04 |
| 1.31 | 1.40 | 0.54 | 0.03 | 0.06 |
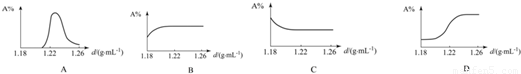
查看答案和解析>>
科目: 来源:2013年第二十三届“天原杯”全国初中学生化学素质和实验能力竞赛复赛试卷(解析版) 题型:填空题
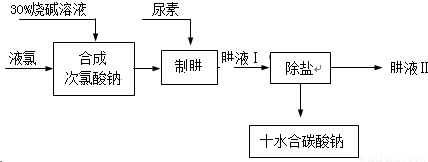
查看答案和解析>>
科目: 来源:2013年第二十三届“天原杯”全国初中学生化学素质和实验能力竞赛复赛试卷(解析版) 题型:填空题
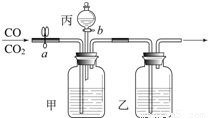 在实验室用如图所示装置进行CO和CO2的分离和干燥.现只有稀盐酸、浓硫酸、氢氧化钠溶液,按要求填写下列空白.操作过程:应先关闭b,再打开a,乙中排出 气体.若获得另一种气体,丙中盛放的溶液为 ,操作为 ,此刻甲中反应的化学方程式: .
在实验室用如图所示装置进行CO和CO2的分离和干燥.现只有稀盐酸、浓硫酸、氢氧化钠溶液,按要求填写下列空白.操作过程:应先关闭b,再打开a,乙中排出 气体.若获得另一种气体,丙中盛放的溶液为 ,操作为 ,此刻甲中反应的化学方程式: .查看答案和解析>>
科目: 来源:2013年第二十三届“天原杯”全国初中学生化学素质和实验能力竞赛复赛试卷(解析版) 题型:填空题
 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com