



科目:初中物理 来源: 题型:阅读理解
 5Fe3++Mn2++4H2O。高锰酸钾标准溶液可用性质稳定、相对分子质量较大的基准物质草酸钠[Mr(Na2C2O4)=134.0]进行标定,反应原理为:5C2O42-+2MnO4-+16H+
5Fe3++Mn2++4H2O。高锰酸钾标准溶液可用性质稳定、相对分子质量较大的基准物质草酸钠[Mr(Na2C2O4)=134.0]进行标定,反应原理为:5C2O42-+2MnO4-+16H+ 10CO2↑+2Mn2++8H2O。
10CO2↑+2Mn2++8H2O。
查看答案和解析>>
科目:初中物理 来源: 题型:
一瓶久置的氢氧化钠固体已经发生了变质。某研究性学习小组为了探究变质程度,作出如下猜想:可能部分变质,固体是NaOH和 Na2CO3的混合物;
可能全部变质,固体是Na2CO3。
(1)首先对固体的成分进行确定。取少量固体于试管中,加水充分溶解,先加入足量的BaCl2 溶液,产生白色沉淀,静置后取上层清液,再加入CuSO4 溶液,产生蓝色絮状沉淀。根据实验现象,可确定该固体是 ▲ ;
(2)称取10.6g 该固体样品于锥形瓶中,加入一定质量分数的稀盐酸,直至过量,得到数据如下表:
样品质量 | 反应前总质量 | 反应后总质量 |
10.6克 | 148.5克 | 146.3克 |
计算该样品中Na2CO3的质量分数。
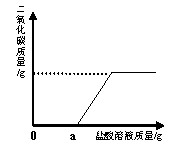
(3)再取固体样品溶于水,加入一定质量分数的稀盐酸,
直至过量。测出加入稀盐酸的质量与产生CO2气体的
质量关系如右图所示。从图中可以判断:在该样品溶液中加入稀盐酸,首先与之反应的物质是 ▲ 。
(4)请你分析,一定质量的NaOH固体,变质前后与相同质量分数的稀盐酸反应, 变质前消耗盐酸的量 ▲ 变质后消耗盐酸的量(填“大于”、“小于”或“等于”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com