6分)
(I)常温下将0.01molCH3COONa和0.004mol盐酸溶于水,配成0. 5L混合溶液。
(1)溶液中共有________种微粒。
(2)溶液中有两种微粒的物质的量之和一定等于0.01mol,它们是____________。
(3)溶液中n(CH3COO-)+n(OH-)-n(H+)=_________mol。
(II)在一定温度下,向AgI的饱和溶液中:(填“增大”、“减小”或“不变”)
(1)若加入AgNO3固体,c(I-) 。
(2)若加入更多的AgI固体,则c(Ag+)
(3)若加入固体AgBr,c(I-) 。
(I) (1)7 (2)CH
3COOH和CH
3COO
- (3)0.006
(II) (1)减小 (2)不变 (3)减小解析:
(1)混合后二者发生反应CH
3COONa+HCl=NaCl+CH
3COOH,其中醋酸钠过量。醋酸是弱电解质,存在电离平衡。醋酸钠存在水解平衡。所以含有的微粒Na
+、H
+、OH
-、Cl
-、CH
3COO
-、CH
3COOH、H
2O共7种。根据原子守恒可知、CH
3COO
-和CH
3COOH物质的量之和一定等于0.01mol。根据电荷守恒可知溶液中n(CH
3COO
-)+n(OH
-)-n(H
+)= n(Na
+)-n(Cl
-)=0.01mol-0.004mol=0.006mol。
(2)AgI的饱和溶液中存在碘化银的溶解平衡
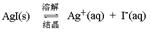
,加入AgNO
3固体,增大银离子浓度,平衡向逆反应方向移动,c(I
-)减小。溶液已经是饱和溶液,因此即使加入更多的AgI固体,c(Ag
+)也不变。溴化银的溶解度大于碘化银的,所以加入固体AgBr后,溶液中银离子浓度会增大,平衡向逆反应方向移动,c(I
-)减小。

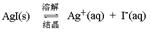 ,加入AgNO3固体,增大银离子浓度,平衡向逆反应方向移动,c(I-)减小。溶液已经是饱和溶液,因此即使加入更多的AgI固体,c(Ag+)也不变。溴化银的溶解度大于碘化银的,所以加入固体AgBr后,溶液中银离子浓度会增大,平衡向逆反应方向移动,c(I-)减小。
,加入AgNO3固体,增大银离子浓度,平衡向逆反应方向移动,c(I-)减小。溶液已经是饱和溶液,因此即使加入更多的AgI固体,c(Ag+)也不变。溴化银的溶解度大于碘化银的,所以加入固体AgBr后,溶液中银离子浓度会增大,平衡向逆反应方向移动,c(I-)减小。 

 计算高手系列答案
计算高手系列答案