80克水温度降低1℃所放出的热量刚好能使1克0℃的冰熔解为水.现把10克0℃的冰与390克4℃的水混合,当它们达到热平衡时的温度是多少?
【答案】
分析:(1)根据80克水温度降低1℃所放出的热量刚好能使1克0℃的冰熔解为水利用放热公式求出1克0℃的冰熔解为水所需要的热量;据此可知10克0℃的冰熔解为水所需的热量,然后比较这个热量会将390克4℃的水降低多少;
(2)然后根据热平衡方程求出390克降低后的水和10克0℃的水混合后的温度即可.
解答:解:1克0℃的冰熔解为水需要的热量为Q
溶解=Q
放0=cm
△t
=4.2×10
3J/(kg?℃)×0.08kg×1℃=336J,
则10克0℃的冰熔解为水需要的热量为Q′=m
1Q
溶解=10×336J=3360J,
∴熔解10g的冰时使390克4℃的水降低后温度为t
2=t
20-
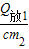
=t
20-

=4℃-
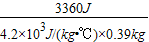
=1.94℃,
由此可知:390克4℃的水使10克0℃的冰熔解成0℃的水时,390克的水降低后的温度为1.94℃;则它们在一起混合时根据热平衡方程得:
cm
1(t′-t
1)=cm
2(t
2-t′)
即:4.2×10
3J/(kg?℃)×0.01kg×(t′-0℃)=4.2×10
3J/(kg?℃)×0.39kg×(1.94℃-t′)
解得:t′=1.8915℃.
答:10克0℃的冰与390克4℃的水混合,当它们达到热平衡时的温度是1.8915℃.
点评:本题主要考查学生对吸热公式和放热公式的掌握和运用,知道热传递的条件、方向结果,注意冰熔解过程需要吸热且温度没有升高,是本题的关键.

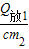 =t20-
=t20- =4℃-
=4℃-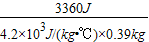 =1.94℃,
=1.94℃,

 小题狂做系列答案
小题狂做系列答案