(8分)某物质A的产量可以用来衡量一个国家的石油化工发展水平。其与水加成的产物B是一种常用的有机溶剂,在生活中有重要的应用。
(1) A的电子式为________,B的分子式为________。
若用B与O2制成燃料电池,并以稀硫酸溶液为电解质溶液,回答(2)-(5)题:
(2)负极上的电极反应式为_______________________________________。
(3)消耗标准状况下的5.6 L O2时,有__________mol电子发生转移。
(4)开始放电时,正极附近溶液的pH__________(填“增大”、“减小”或“不变”);
(5)溶液中H+由___________区向__________区移动(填“正极”或“负极”)。
(1)
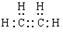
;分子式 C
2H
6O
(2) C
2H
6O -12e
- +3H
2O =12H
+ +2CO
2 ↑ (3) 1 (4) 增大 (5) 负极 正极
评分标准:(2)电极反应式为2分,其它每空一分解析:
(1)用来衡量一个国家的石油化工发展水平是乙烯的产量,所以A是乙烯,含有极性键和非极性键。乙烯和水发生加成反应,生成乙醇,分子式为C
2H
6O。
(2)在原电池中负极失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。所以在乙醇在负极通入,失去电子,生成CO
2和水。氧气在正极得到电子,并结合溶液中的氢离子生成水。电极反应式分别是C
2H
6O -12e
- +3H
2O =12H
+ +2CO
2↑、3O
2+12e
-+12H
+=6H
2O。因此正极附近溶液的pH增大。5.6L氧气是0.25mol,转移电子是0.25mol×4=1.0mol。

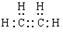 ;分子式 C2H6O
;分子式 C2H6O
